第112页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
15. 下图是配制$50\ \mathrm{g}溶质质量分数为6\%$的氯化钠溶液的操作图,回答下列问题。
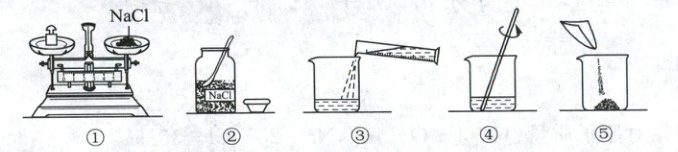
(1)配制溶液过程中,所需的玻璃仪器有玻璃棒、
(2)需配制的溶液中,溶质和溶液的质量比为
(3)图中操作不规范的步骤是
(4)量取水时,选择
(5)将配制好的溶液存放在
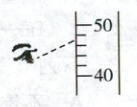
(6)在其他操作无误的前提下,用量筒量取水时按如图所示操作,会使所配制溶液的溶质质量分数
(7)称量氯化钠时如果发现指针偏向右侧,正确的操作是
(8)取配制好的该溶液$10\ \mathrm{g}$,将其配制成$3\%$的溶液,需要加水的质量为

(1)配制溶液过程中,所需的玻璃仪器有玻璃棒、
烧杯、量筒
,玻璃棒的作用是搅拌,加速溶解
。(2)需配制的溶液中,溶质和溶液的质量比为
3:50
。(3)图中操作不规范的步骤是
①
(填序号,下同);将图中的不规范操作改正后,图示实验的正确操作顺序是②①⑤③④
。(4)量取水时,选择
50
$\mathrm{mL}$的量筒最合适,读数时视线应与凹液面的最低处
保持水平。(5)将配制好的溶液存放在
细口瓶
(填“广口瓶”或“细口瓶”)中后贴上标签,在标签上填写:氯化钠溶液
和6%
。(6)在其他操作无误的前提下,用量筒量取水时按如图所示操作,会使所配制溶液的溶质质量分数
偏小
(填“偏大”“偏小”或“不变”)。
(7)称量氯化钠时如果发现指针偏向右侧,正确的操作是
继续向左盘添加氯化钠直至天平平衡
;如果称量时氯化钠和砝码位置放反了($1\ \mathrm{g}$以下用游码),其他操作步骤均正确,则所配制的溶液的溶质质量分数等于
(填“大于”“等于”或“小于”)$6\%$。(8)取配制好的该溶液$10\ \mathrm{g}$,将其配制成$3\%$的溶液,需要加水的质量为
10
$\mathrm{g}$。
答案:
(1)烧杯、量筒;搅拌,加速溶解
(2)3:50
(3)①;②①⑤③④
(4)50;凹液面的最低处
(5)细口瓶;氯化钠溶液;6%
(6)偏小
(7)继续向左盘添加氯化钠直至天平平衡;等于
(8)10
(2)3:50
(3)①;②①⑤③④
(4)50;凹液面的最低处
(5)细口瓶;氯化钠溶液;6%
(6)偏小
(7)继续向左盘添加氯化钠直至天平平衡;等于
(8)10
16. “二氧化碳的实验室制取与性质”实验活动产生的废液中含稀盐酸,需先测定其溶质质量分数后再进行处理。(杂质不参与反应,氯化钙溶液呈中性)
(1)实验时需配制$50\ \mathrm{g}\ 5\%$的氢氧化钠溶液。若用氢氧化钠固体和水来配制,则需称量氢氧化钠固体的质量为
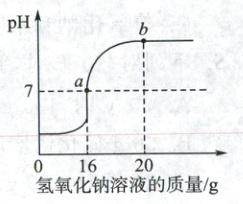
(2)取$20\ \mathrm{g}$废液样品于烧杯中,向其中逐滴加入$5\%$的氢氧化钠溶液,废液的$\mathrm{pH}$随加入的氢氧化钠溶液的变化如图所示。计算废液中氯化氢的溶质质量分数。(写出计算过程)
(3)恰好完全反应时,烧杯中的溶液所含粒子数目关系为:$\mathrm{Na^+}$
(1)实验时需配制$50\ \mathrm{g}\ 5\%$的氢氧化钠溶液。若用氢氧化钠固体和水来配制,则需称量氢氧化钠固体的质量为
2.5
$\mathrm{g}$。
(2)取$20\ \mathrm{g}$废液样品于烧杯中,向其中逐滴加入$5\%$的氢氧化钠溶液,废液的$\mathrm{pH}$随加入的氢氧化钠溶液的变化如图所示。计算废液中氯化氢的溶质质量分数。(写出计算过程)
(3)恰好完全反应时,烧杯中的溶液所含粒子数目关系为:$\mathrm{Na^+}$
=
(填“$>$”“$<$”或“$=$”)$\mathrm{Cl^-}$。
答案:
(1) 2.5
(2) 解:由图可知,恰好完全反应时消耗5%的氢氧化钠溶液质量为16g。
氢氧化钠的质量:16g×5%=0.8g
设20g废液中HCl的质量为x。
NaOH + HCl = NaCl + H₂O
40 36.5
0.8g x
40/36.5 = 0.8g/x
x= (36.5×0.8g)/40=0.73g
废液中HCl的溶质质量分数:(0.73g/20g)×100%=3.65%
(3) =
(1) 2.5
(2) 解:由图可知,恰好完全反应时消耗5%的氢氧化钠溶液质量为16g。
氢氧化钠的质量:16g×5%=0.8g
设20g废液中HCl的质量为x。
NaOH + HCl = NaCl + H₂O
40 36.5
0.8g x
40/36.5 = 0.8g/x
x= (36.5×0.8g)/40=0.73g
废液中HCl的溶质质量分数:(0.73g/20g)×100%=3.65%
(3) =
查看更多完整答案,请扫码查看


