第58页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
18. 化学是以实验为基础的学科,开展实验探究是学习化学的重要手段。
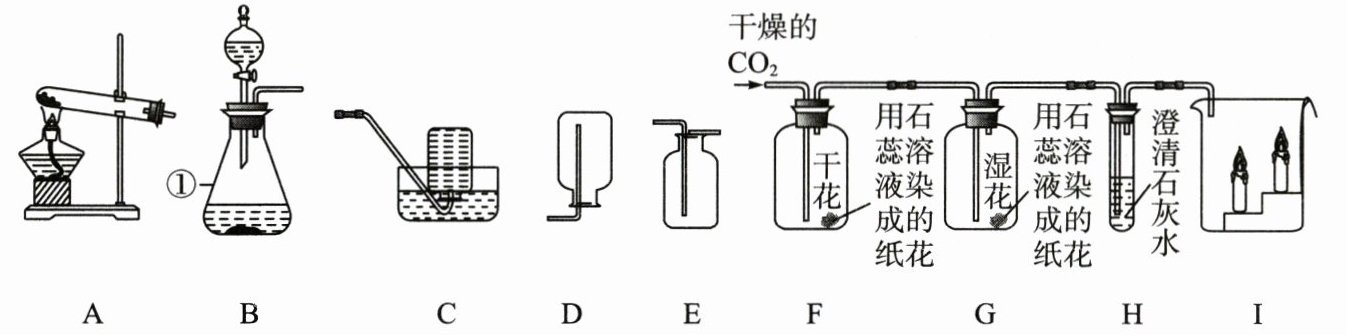
(1)写出有标号①的仪器名称:
(2)实验室用过氧化氢溶液和二氧化锰制氧气选用的发生装置是
(3)实验室制取二氧化碳的化学方程式为
(4)证明${CO_{2}}能与{H_{2}O}$反应的现象是
(5)$H$中实验现象为
(6)若看到烧杯$I$中蜡烛从下往上依次熄灭,说明${CO_{2}}$具有的性质是

(1)写出有标号①的仪器名称:
锥形瓶
。(2)实验室用过氧化氢溶液和二氧化锰制氧气选用的发生装置是
B
(填字母),反应的化学方程式为2H₂O₂$\xlongequal{MnO_2}$2H₂O+O₂↑
。用装置$E$收集氧气,检验是否集满的方法是将带火星的木条放在集气瓶口,若木条复燃,则证明集满
(写出操作、现象和结论)。(3)实验室制取二氧化碳的化学方程式为
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
。选择的发生装置和收集装置的组合是BE
(填字母)。(4)证明${CO_{2}}能与{H_{2}O}$反应的现象是
F处纸花不变色,G处纸花变红
。(5)$H$中实验现象为
澄清石灰水变浑浊
,发生反应的化学方程式为CO₂+Ca(OH)₂=CaCO₃↓+H₂O
。(6)若看到烧杯$I$中蜡烛从下往上依次熄灭,说明${CO_{2}}$具有的性质是
密度比空气大,不燃烧,也不支持燃烧
。
答案:
18.
(1)锥形瓶
(2)B 2H₂O₂$\xlongequal{MnO_2}$2H₂O+O₂↑ 将带火星的木条放在集气瓶口,若木条复燃,则证明集满
(3)CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ BE
(4)F处纸花不变色,G处纸花变红
(5)澄清石灰水变浑浊 CO₂+Ca(OH)₂=CaCO₃↓+H₂O
(6)密度比空气大,不燃烧,也不支持燃烧 解析
(1)仪器①是锥形瓶。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,该反应属于固液常温型,选择的发生装置为B,过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为2H₂O₂$\xlongequal{MnO_2}$2H₂O+O₂↑;用装置E(向上排空气法)收集氧气,验满的方法是:将带火星的木条放在集气瓶口,若木条复燃,则证明集满。
(3)实验室制取CO₂,在常温下用大理石或石灰石(主要含有碳酸钙)和稀盐酸制取,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式是CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑;该反应的反应物为固体和液体,反应条件为常温,该反应的发生装置为固液不加热,选择的发生装置为B,二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,即E。
(4)二氧化碳不能使紫色石蕊干花变红,但二氧化碳与水反应生成的碳酸可以使石蕊溶液变红,得出二氧化碳能与水发生化学反应的结论,证据是:F处纸花不变色,G处纸花变红。
(5)H中澄清石灰水会变浑浊,因为石灰水中的氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水,化学方程式是CO₂+Ca(OH)₂=CaCO₃↓+H₂O。
(6)烧杯I中蜡烛从下往上依次熄灭,说明CO₂具有的性质是密度大于空气,不燃烧,也不支持燃烧。
(1)锥形瓶
(2)B 2H₂O₂$\xlongequal{MnO_2}$2H₂O+O₂↑ 将带火星的木条放在集气瓶口,若木条复燃,则证明集满
(3)CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ BE
(4)F处纸花不变色,G处纸花变红
(5)澄清石灰水变浑浊 CO₂+Ca(OH)₂=CaCO₃↓+H₂O
(6)密度比空气大,不燃烧,也不支持燃烧 解析
(1)仪器①是锥形瓶。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,该反应属于固液常温型,选择的发生装置为B,过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为2H₂O₂$\xlongequal{MnO_2}$2H₂O+O₂↑;用装置E(向上排空气法)收集氧气,验满的方法是:将带火星的木条放在集气瓶口,若木条复燃,则证明集满。
(3)实验室制取CO₂,在常温下用大理石或石灰石(主要含有碳酸钙)和稀盐酸制取,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式是CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑;该反应的反应物为固体和液体,反应条件为常温,该反应的发生装置为固液不加热,选择的发生装置为B,二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,即E。
(4)二氧化碳不能使紫色石蕊干花变红,但二氧化碳与水反应生成的碳酸可以使石蕊溶液变红,得出二氧化碳能与水发生化学反应的结论,证据是:F处纸花不变色,G处纸花变红。
(5)H中澄清石灰水会变浑浊,因为石灰水中的氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水,化学方程式是CO₂+Ca(OH)₂=CaCO₃↓+H₂O。
(6)烧杯I中蜡烛从下往上依次熄灭,说明CO₂具有的性质是密度大于空气,不燃烧,也不支持燃烧。
19. 为检查某石灰石样品中碳酸钙的纯度,取该样品$12\ {g}$放入烧杯中,再向烧杯中加入$35\ {g}$稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共$42.6\ {g}$。
(1)反应生成${CO_{2}}$的质量为
(2)计算石灰石样品中碳酸钙的质量分数(结果保留到$0.1\%$,写出计算过程)。
(1)反应生成${CO_{2}}$的质量为
4.4
${g}$。(2)计算石灰石样品中碳酸钙的质量分数(结果保留到$0.1\%$,写出计算过程)。
解:设生成4.4 g CO₂需要碳酸钙的质量为x。 CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ 100 44 x 4.4 g $\frac{100}{44}=\frac{x}{4.4\ g}$ x=10 g 则石灰石样品中碳酸钙的质量分数为$\frac{10\ g}{12\ g}$×100%≈83.3%。 答:石灰石样品中碳酸钙的质量分数为83.3%。
答案:
19.
(1)4.4
(2)解:设生成4.4 g CO₂需要碳酸钙的质量为x。 CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ 100 44 x 4.4 g $\frac{100}{44}=\frac{x}{4.4\ g}$ x=10 g 则石灰石样品中碳酸钙的质量分数为$\frac{10\ g}{12\ g}$×100%≈83.3%。 答:石灰石样品中碳酸钙的质量分数为83.3%。
(1)4.4
(2)解:设生成4.4 g CO₂需要碳酸钙的质量为x。 CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ 100 44 x 4.4 g $\frac{100}{44}=\frac{x}{4.4\ g}$ x=10 g 则石灰石样品中碳酸钙的质量分数为$\frac{10\ g}{12\ g}$×100%≈83.3%。 答:石灰石样品中碳酸钙的质量分数为83.3%。
查看更多完整答案,请扫码查看


