第22页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
19. 有下列五种粒子的结构示意图。回答下列问题。
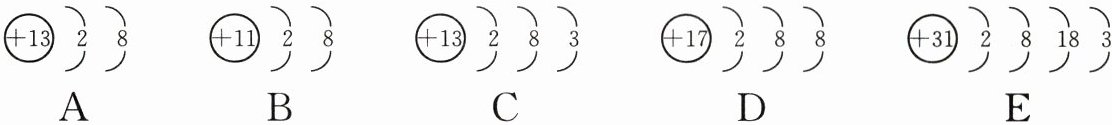
(1)以上示意图中,共有
(2)E 原子在化学反应中易
(3)A 粒子中的质子数为
(4)以上五种粒子中,表示原子的是
(5)上述五种粒子中,达到稳定结构的是
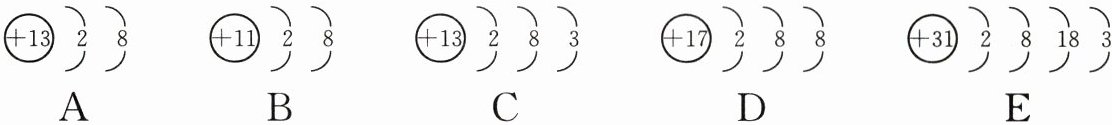
(1)以上示意图中,共有
4(或四)
种元素,属于同种元素的是AC
(填字母)。(2)E 原子在化学反应中易
失去
(填“得到”或“失去”)电子。(3)A 粒子中的质子数为
13
,D 离子的符号为Cl⁻
。(4)以上五种粒子中,表示原子的是
CE
(填字母,下同),表示阳离子的是AB
,表示阴离子的是D
。(5)上述五种粒子中,达到稳定结构的是
ABD
(填字母)。
答案:
(1)4(或四) AC
(2)失去
(3)13 Cl⁻
(4)CE AB D
(5)ABD 解析
(1)元素种类由质子数决定,质子数相同的原子属于同种元素,图示五种粒子中,质子数分别为13、11、13、17、31,共有4种元素;由图示可知,A与C粒子的质子数相同,属于同种元素。
(2)由图示可知,E原子的最外层电子数为3,小于4,所以在化学变化中容易失去最外层的3个电子。
(3)由图示可知,A粒子的核电荷数为13,故A粒子的质子数为13;D粒子中质子数为17,则D元素为氯元素,且D粒子核外电子数为18,所以D粒子为氯离子,其离子符号为Cl⁻。
(4)原子中,核电荷数等于核外电子数,图示五种粒子中,C、E两种粒子满足此条件,所以C、E为原子结构;阳离子中,核电荷数>核外电子数,图示五种粒子中,A、B两种粒子满足此条件,所以A、B为阳离子结构;阴离子中,核电荷数<核外电子数,图示五种粒子中,D粒子满足此条件,所以D为阴离子结构。
(5)由图示可知,题中五种粒子中,A、B、D最外层电子数都为8,故五种粒子中,达到稳定结构的是A、B、D。
(1)4(或四) AC
(2)失去
(3)13 Cl⁻
(4)CE AB D
(5)ABD 解析
(1)元素种类由质子数决定,质子数相同的原子属于同种元素,图示五种粒子中,质子数分别为13、11、13、17、31,共有4种元素;由图示可知,A与C粒子的质子数相同,属于同种元素。
(2)由图示可知,E原子的最外层电子数为3,小于4,所以在化学变化中容易失去最外层的3个电子。
(3)由图示可知,A粒子的核电荷数为13,故A粒子的质子数为13;D粒子中质子数为17,则D元素为氯元素,且D粒子核外电子数为18,所以D粒子为氯离子,其离子符号为Cl⁻。
(4)原子中,核电荷数等于核外电子数,图示五种粒子中,C、E两种粒子满足此条件,所以C、E为原子结构;阳离子中,核电荷数>核外电子数,图示五种粒子中,A、B两种粒子满足此条件,所以A、B为阳离子结构;阴离子中,核电荷数<核外电子数,图示五种粒子中,D粒子满足此条件,所以D为阴离子结构。
(5)由图示可知,题中五种粒子中,A、B、D最外层电子数都为8,故五种粒子中,达到稳定结构的是A、B、D。
20. 元素周期表是学习化学的重要工具。如图是元素周期表的一部分,请回答下列问题。
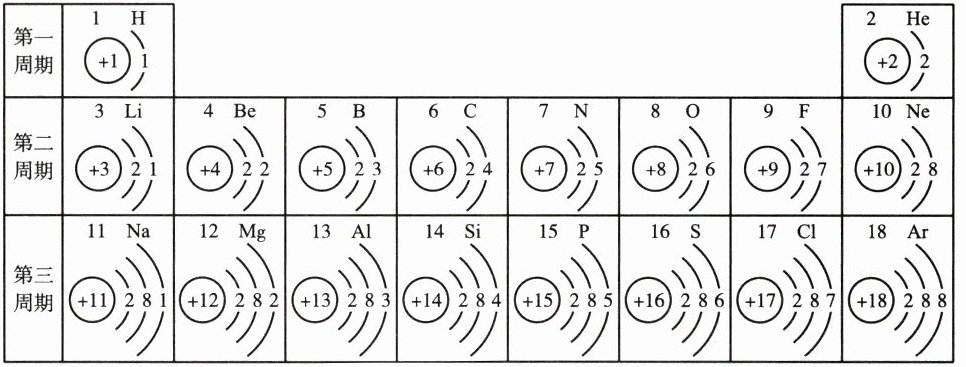
(1)不同元素之间的最本质区别是
(2)表中与氧元素化学性质相似的是
(3)12 号元素的原子在化学反应中比较容易
(4)11~18 号元素在表中处于同一周期的原因是它们原子结构中的
(5)钠离子核外电子排布与

(1)不同元素之间的最本质区别是
质子数(或核电荷数)
不同。(2)表中与氧元素化学性质相似的是
S
(填元素符号)元素,原因是原子核外最外层电子数相同
。(3)12 号元素的原子在化学反应中比较容易
失去
(填“得到”或“失去”)电子。(4)11~18 号元素在表中处于同一周期的原因是它们原子结构中的
电子层数
相同。(5)钠离子核外电子排布与
Ne
(填元素符号)原子核外电子排布相同。
答案:
(1)质子数(或核电荷数)
(2)S 原子核外最外层电子数相同
(3)失去
(4)电子层数
(5)Ne 解析
(1)元素是质子数(或核电荷数)相同的一类原子的总称,所以决定元素种类的是质子数(即核电荷数),不同元素之间的本质区别是质子数或核电荷数不同。
(2)根据最外层电子数决定元素的化学性质,氧原子的最外层有6个电子,硫原子的最外层也是6个电子,二者化学性质相似,是因为二者原子核外最外层电子数相同。
(3)12号元素的原子是镁原子,最外层有2个电子,在化学反应中易失去电子,形成阳离子。
(4)11~18号元素在表中处于同一周期的原因是它们原子结构中的电子层数相同。
(5)钠为11号元素,最外层有1个电子,小于4,失去最外层1个电子形成钠离子,其核外电子排布与10号氖原子核外电子排布相同。
(1)质子数(或核电荷数)
(2)S 原子核外最外层电子数相同
(3)失去
(4)电子层数
(5)Ne 解析
(1)元素是质子数(或核电荷数)相同的一类原子的总称,所以决定元素种类的是质子数(即核电荷数),不同元素之间的本质区别是质子数或核电荷数不同。
(2)根据最外层电子数决定元素的化学性质,氧原子的最外层有6个电子,硫原子的最外层也是6个电子,二者化学性质相似,是因为二者原子核外最外层电子数相同。
(3)12号元素的原子是镁原子,最外层有2个电子,在化学反应中易失去电子,形成阳离子。
(4)11~18号元素在表中处于同一周期的原因是它们原子结构中的电子层数相同。
(5)钠为11号元素,最外层有1个电子,小于4,失去最外层1个电子形成钠离子,其核外电子排布与10号氖原子核外电子排布相同。
查看更多完整答案,请扫码查看


