第49页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
14. 完全电解 a g 水,在正极上得到 10 mL 气体,则在负极上得到气体的质量和体积分别是(
A.a g,10 mL
B.$\frac{8}{9}$a g,20 mL
C.$\frac{1}{9}$a g,20 mL
D.$\frac{1}{9}$a g,5 mL
C
)A.a g,10 mL
B.$\frac{8}{9}$a g,20 mL
C.$\frac{1}{9}$a g,20 mL
D.$\frac{1}{9}$a g,5 mL
答案:
C 解析 电解水时,正极和负极分别得到氧气和氢气,其体积比为1:2,若正极得到的气体体积为10mL,则负极得到的气体体积为20mL。通过化学方程式2H₂O$\frac{\underline{通电}}{}$2H₂↑+O₂↑,可计算得到氢气的质量为$\frac{1}{9}$a g。C项正确。
15. 配平下列反应的化学方程式。
(1)
(2)
(3)
(4)
(1)
1
CH₄+2
O₂$\xlongequal{点燃}$1
CO₂+2
H₂O(2)
1
C₂H₅OH+3
O₂$\xlongequal{点燃}$2
CO₂+3
H₂O(3)
3
Mg+1
N₂$\xlongequal{点燃}$1
Mg₃N₂(4)
4
FeS+7
O₂$\xlongequal{点燃}$2
Fe₂O₃+4
SO₂
答案:
(1)1 2 1 2
(2)1 3 2 3
(3)3 1 1
(4)4 7 2 4
(1)1 2 1 2
(2)1 3 2 3
(3)3 1 1
(4)4 7 2 4
16. 查阅图表资料是获取信息的一种重要方法。如图是元素周期表中的一部分,请回答下列问题。
(1)硅元素的相对原子质量为
(2)硅是一种良好的半导体材料。工业上用焦炭还原石英砂(SiO₂)可以制得硅,其反应的化学方程式为 SiO₂+2C$\xlongequal{高温}$Si+2X↑,X 的化学式是
(3)硅酸钠 Na₂SiO₃可用作防火材料,请根据硅酸钠的化学式写出硅酸钙的化学式:
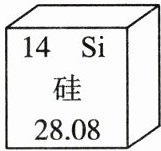
(1)硅元素的相对原子质量为
28.08
,它属于非金属
(填“金属”或“非金属”)元素。(2)硅是一种良好的半导体材料。工业上用焦炭还原石英砂(SiO₂)可以制得硅,其反应的化学方程式为 SiO₂+2C$\xlongequal{高温}$Si+2X↑,X 的化学式是
CO
。(3)硅酸钠 Na₂SiO₃可用作防火材料,请根据硅酸钠的化学式写出硅酸钙的化学式:
CaSiO₃
。
答案:
(1)28.08 非金属
(2)CO
(3)CaSiO₃
(1)28.08 非金属
(2)CO
(3)CaSiO₃
17. 工业制取氨气的反应的微观示意图如下,A、B、C 代表三种物质,回答下列问题。
(1)A 物质的化学式是
(2)反应中,化合价发生改变的元素是
(3)该反应的基本反应类型是
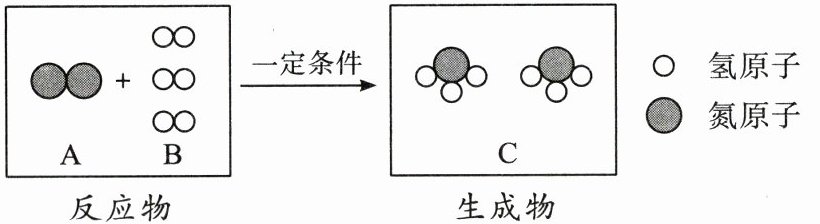
(1)A 物质的化学式是
N₂
;A、B、C 三种物质中属于单质的是AB
(填字母)。(2)反应中,化合价发生改变的元素是
N、H
(填元素符号);B、C 的分子个数比为3:2
。(3)该反应的基本反应类型是
化合反应
。
答案:
(1)N₂ AB
(2)N、H 3:2
(3)化合反应
(1)N₂ AB
(2)N、H 3:2
(3)化合反应
18. 质量守恒定律是自然界最普遍、最重要的基本定律之一。某化学课外小组同学用如图所示实验探究质量守恒定律。
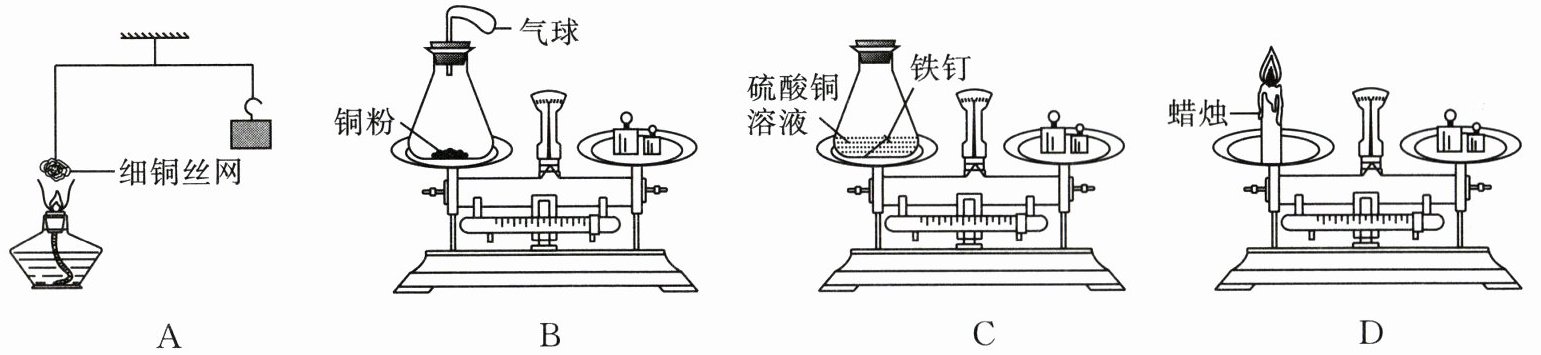
(1)A 实验加热细铜丝网一段时间后移走酒精灯,观察到铜丝表面变为黑色(CuO),细铜丝网
(2)B 实验中发生反应的化学方程式为
(3)B、C、D 三组实验充分反应并冷却至室温后最终天平不能平衡的是(
(4)通过上述实验,你得到的启示是有气体参加或生成的反应,在验证质量守恒定律时应该在
(5)实验拓展:氮气具有广泛的用途,如超导材料在液氮的低温环境下能显示超导性能。从微观角度分析:制取液氮时,在氮气液化过程中发生变化的是(
①分子的大小 ②分子的质量 ③分子间的间隔 ④分子的数目

(1)A 实验加热细铜丝网一段时间后移走酒精灯,观察到铜丝表面变为黑色(CuO),细铜丝网
下沉
。(2)B 实验中发生反应的化学方程式为
2Cu+O₂$\frac{\underline{点燃}}{}$2CuO
。实验过程中,观察到小气球先变鼓再变瘪。其中“变鼓”的原因是铜粉加热时瓶内温度升高,气体受热膨胀
。(3)B、C、D 三组实验充分反应并冷却至室温后最终天平不能平衡的是(
D
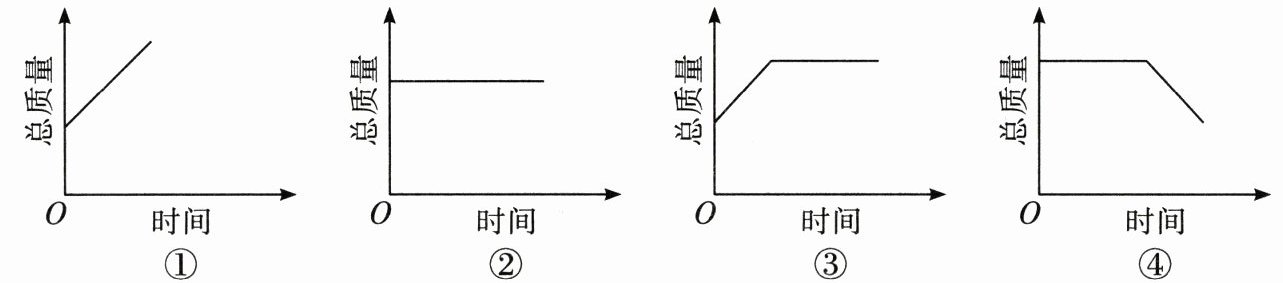
)。在 B 实验中,锥形瓶中物质的总质量随时间的变化关系如下图所示,正确的是(②
)。
(4)通过上述实验,你得到的启示是有气体参加或生成的反应,在验证质量守恒定律时应该在
密闭
装置中进行。(5)实验拓展:氮气具有广泛的用途,如超导材料在液氮的低温环境下能显示超导性能。从微观角度分析:制取液氮时,在氮气液化过程中发生变化的是(
③
)。①分子的大小 ②分子的质量 ③分子间的间隔 ④分子的数目
答案:
(1)下沉
(2)2Cu+O₂$\frac{\underline{点燃}}{}$2CuO 铜粉加热时瓶内温度升高,气体受热膨胀
(3)D ②
(4)密闭
(5)③
(1)下沉
(2)2Cu+O₂$\frac{\underline{点燃}}{}$2CuO 铜粉加热时瓶内温度升高,气体受热膨胀
(3)D ②
(4)密闭
(5)③
查看更多完整答案,请扫码查看


