第53页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
16. 高钙片是一种人体补钙剂,其有效成分是碳酸钙,工业上从石灰石(主要成分为$CaCO_{3}$)获得高纯度$CaCO_{3}$的流程如下。
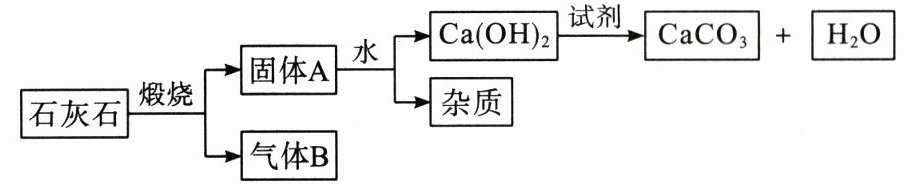
(注:氢氧化钙$[Ca(OH)_{2}]$俗称熟石灰,是重要的建筑材料)
(1)上述生产过程中涉及的分解反应的化学方程式为
(2)固体 A 与$H_{2}O$反应的化学方程式是
(3)气体 B 的用途是
(4)使原料中各原子的利用率尽可能达到 100%是“绿色化学”的核心理念之一。上述流程中有的物质可以再利用,流程图中可以循环利用的物质是

(注:氢氧化钙$[Ca(OH)_{2}]$俗称熟石灰,是重要的建筑材料)
(1)上述生产过程中涉及的分解反应的化学方程式为
CaCO₃$\frac{\underline{高温}}{}$CaO+CO₂↑
。(2)固体 A 与$H_{2}O$反应的化学方程式是
CaO+H₂O=Ca(OH)₂
。(3)气体 B 的用途是
制作汽水、灭火(合理即可)
(写出两种即可)。(4)使原料中各原子的利用率尽可能达到 100%是“绿色化学”的核心理念之一。上述流程中有的物质可以再利用,流程图中可以循环利用的物质是
CaCO₃(或H₂O或CO₂)
(写出一种即可,填化学式)。
答案:
(1)CaCO₃$\frac{\underline{高温}}{}$CaO+CO₂↑;
(2)CaO+H₂O=Ca(OH)₂;
(3)制作汽水、灭火(合理即可);
(4)CaCO₃(或H₂O或CO₂)
(1)CaCO₃$\frac{\underline{高温}}{}$CaO+CO₂↑;
(2)CaO+H₂O=Ca(OH)₂;
(3)制作汽水、灭火(合理即可);
(4)CaCO₃(或H₂O或CO₂)
17. 二氧化碳是一种温室气体。某化学兴趣小组利用如下图所示装置对二氧化碳的性质进行验证。
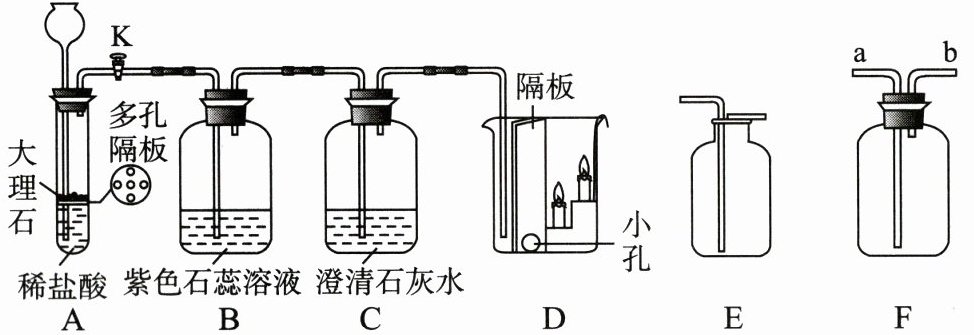
(1)A 装置相比其他固液常温装置,优点是
(2)用 E 装置收集二氧化碳,并验证二氧化碳是否收集满,验满的方法为
(3)若用图 F 装置收集二氧化碳,气体应从

(1)A 装置相比其他固液常温装置,优点是
可以控制反应的发生和停止
。(2)用 E 装置收集二氧化碳,并验证二氧化碳是否收集满,验满的方法为
将燃着的木条放在集气瓶口,观察木条是否熄灭,若熄灭,则已满;反之,则未集满
;结果发现小木条始终不灭,说明该瓶气体没有集满。出现上述情况的原因可能是装置漏气
。(3)若用图 F 装置收集二氧化碳,气体应从
a
(填“a”或“b”)端通入;当打开 K,反应一段时间后,D 烧杯中下层的蜡烛先熄灭,说明二氧化碳具有的性质是不燃烧,不支持燃烧,密度比空气大
;B 处的现象是溶液变红
,发生反应的化学方程式为CO₂+H₂O=H₂CO₃
。
答案:
(1)可以控制反应的发生和停止;
(2)将燃着的木条放在集气瓶口,观察木条是否熄灭,若熄灭,则已满;反之,则未集满 装置漏气;
(3)a 不燃烧,不支持燃烧,密度比空气大 溶液变红 CO₂+H₂O=H₂CO₃ 解析
(1)由装置的特点可知,稀盐酸从长颈漏斗中加入,反应后关闭开关时,试管中的气体增多,压强增大,把稀盐酸压入长颈漏斗,大理石和稀盐酸分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,大理石和稀盐酸混合,反应进行;故优点是可以控制反应的发生和停止。
(2)用E装置收集二氧化碳,并验证二氧化碳是否收集满,验满的方法为:将燃着的木条放在集气瓶口,观察木条是否熄灭,若熄灭,则已满;反之,则未集满。若小木条始终不灭,说明该瓶气体没有集满,出现上述情况的原因可能是装置漏气。
(3)若用图F装置收集二氧化碳,由于二氧化碳的密度比空气的大,气体应长进短出,从a端通入;当打开K,反应一段时间后,D烧杯中下层的蜡烛先熄灭,说明二氧化碳具有的性质是不燃烧,不支持燃烧,且密度比空气的大;二氧化碳能和水反应生成碳酸,能使紫色石蕊溶液变红,故B处的现象是溶液变红,发生反应的化学方程式为CO₂+H₂O=H₂CO₃。
(1)可以控制反应的发生和停止;
(2)将燃着的木条放在集气瓶口,观察木条是否熄灭,若熄灭,则已满;反之,则未集满 装置漏气;
(3)a 不燃烧,不支持燃烧,密度比空气大 溶液变红 CO₂+H₂O=H₂CO₃ 解析
(1)由装置的特点可知,稀盐酸从长颈漏斗中加入,反应后关闭开关时,试管中的气体增多,压强增大,把稀盐酸压入长颈漏斗,大理石和稀盐酸分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,大理石和稀盐酸混合,反应进行;故优点是可以控制反应的发生和停止。
(2)用E装置收集二氧化碳,并验证二氧化碳是否收集满,验满的方法为:将燃着的木条放在集气瓶口,观察木条是否熄灭,若熄灭,则已满;反之,则未集满。若小木条始终不灭,说明该瓶气体没有集满,出现上述情况的原因可能是装置漏气。
(3)若用图F装置收集二氧化碳,由于二氧化碳的密度比空气的大,气体应长进短出,从a端通入;当打开K,反应一段时间后,D烧杯中下层的蜡烛先熄灭,说明二氧化碳具有的性质是不燃烧,不支持燃烧,且密度比空气的大;二氧化碳能和水反应生成碳酸,能使紫色石蕊溶液变红,故B处的现象是溶液变红,发生反应的化学方程式为CO₂+H₂O=H₂CO₃。
18. CO 是一种无色、无臭、有毒的可燃气体,能还原某些氧化物,可用于冶金工业。某兴趣小组为探究其能还原某些氧化物的性质,设计了如图实验装置。请回答以下有关问题。
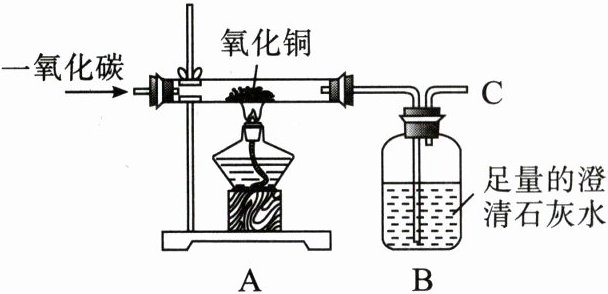
(1)CO 和$CO_{2}$的组成元素相同,但它们的性质不同的原因是
(2)CO 气体能使人中毒,其原因是
(3)实验开始时,先通入 CO 一段时间后,再加热,其原因是
(4)实验过程中,图中 A 处观察到的实验现象是
(5)该装置存在的不足之处是

(1)CO 和$CO_{2}$的组成元素相同,但它们的性质不同的原因是
它们是由不同的分子构成的
。(2)CO 气体能使人中毒,其原因是
一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能再与氧气结合,造成人体缺氧
。(3)实验开始时,先通入 CO 一段时间后,再加热,其原因是
排尽装置内的空气,防止加热时爆炸
。(4)实验过程中,图中 A 处观察到的实验现象是
粉末由黑色逐渐变成红色
,发生反应的化学方程式为CuO+CO$\frac{\underline{\triangle }}{}$Cu+CO₂
,B 中发生反应的化学方程式为CO₂+Ca(OH)₂=CaCO₃↓+H₂O
。(5)该装置存在的不足之处是
在C处没有尾气处理装置
。
答案:
(1)它们是由不同的分子构成的;
(2)一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能再与氧气结合,造成人体缺氧;
(3)排尽装置内的空气,防止加热时爆炸;
(4)粉末由黑色逐渐变成红色 CuO+CO$\frac{\underline{\triangle }}{}$Cu+CO₂ CO₂+Ca(OH)₂=CaCO₃↓+H₂O;
(5)在C处没有尾气处理装置
(1)它们是由不同的分子构成的;
(2)一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能再与氧气结合,造成人体缺氧;
(3)排尽装置内的空气,防止加热时爆炸;
(4)粉末由黑色逐渐变成红色 CuO+CO$\frac{\underline{\triangle }}{}$Cu+CO₂ CO₂+Ca(OH)₂=CaCO₃↓+H₂O;
(5)在C处没有尾气处理装置
查看更多完整答案,请扫码查看


