2025年教材帮高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年教材帮高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第69页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
4.[变情境]N2和O2反应生成NO时的能量变化如图
所示。下列说法正确的是 )

A.NO(g)分解为N2(g)与O2(g)的反应为放热反应
B.N2(g)和O2(g)反应生成1molNO(g)时放出630kJ
能量
C.断开02中氧氧键形成1mol氧原子需要吸收498kJ
能量
D.1molN2(g)的能量大于1molNO(g)的能量
所示。下列说法正确的是 )

A.NO(g)分解为N2(g)与O2(g)的反应为放热反应
B.N2(g)和O2(g)反应生成1molNO(g)时放出630kJ
能量
C.断开02中氧氧键形成1mol氧原子需要吸收498kJ
能量
D.1molN2(g)的能量大于1molNO(g)的能量
答案:
4.A A、B项:1molN₂(g)与1molO₂(g)反应生成2molNO(g)时,断开反应物中的化学键所吸收的总能量为(945kJ + 498kJ)=1443kJ,形成生成物中的化学键所放出的总能量为(2×630)kJ = 1260kJ,则该反应吸收(1443−1260)kJ = 183kJ能量,故N₂(g)+O₂(g)=2NO(g)为吸热反应,其逆向反应2NO(g)=N₂(g)+O₂(g)为放热反应(A√、B×)。
C项:形成1mol氧原子仅需断裂0.5molO₂中氧氧键,故需要吸收249kJ能量(×)。
D项:断开1molN₂(g)中氮氮键需要吸收的能量(945kJ)大于断开1molNO(g)中氮氧键需要吸收的能量(630kJ),说明N₂(g)比NO(g)稳定,即1molN₂(g)的能量小于1molNO(g)的能量(×)。
C项:形成1mol氧原子仅需断裂0.5molO₂中氧氧键,故需要吸收249kJ能量(×)。
D项:断开1molN₂(g)中氮氮键需要吸收的能量(945kJ)大于断开1molNO(g)中氮氧键需要吸收的能量(630kJ),说明N₂(g)比NO(g)稳定,即1molN₂(g)的能量小于1molNO(g)的能量(×)。
例17[新趋势.命题结构化](2024福建厦门双十中学月考)原电池原理在生产生活中有着广泛的应用,请回答下列问题:
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。利用反应“Cu+2Ag+−
2Ag+Cu²+”设计原电池,该电池的负极发生
(填“氧化”或“还原”)反应,电解质
溶液是溶液。
(2)为了探究化学反应中的能量变化,某同学
设计了相同条件下如图甲、乙(铜、锌之间用导
线连接)所示的两个实验,反应一段时间后,可
观察到的现象错误的是(填标号)。
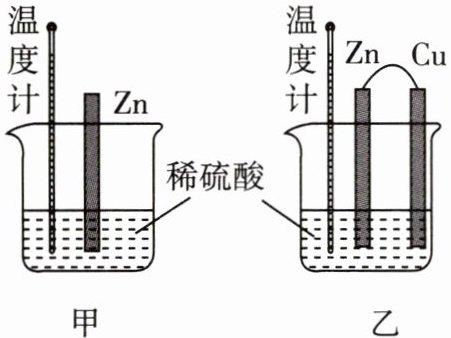
A.图甲和图乙中温度计示数均高于室温
B.反应相同时间时温度计示数:图甲>图乙
C.图甲和图乙只在锌棒表面产生气泡
D.产生气泡的速率:图乙>图甲
(3)[教材改编题.来源于教材P54第6题]某
同学利用原电池反应检测金属的活动性顺序,
设计了相同条件下如图丙、丁所示的两个实验。
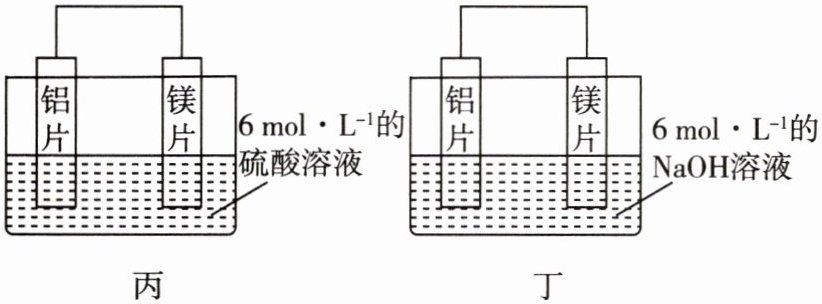
①图丙中放电时H+向(填“镁片”或
“铝片”)移动。
②图丁中铝片为极,其电极反应式为
。
③依据该实验得出的下列结论中,正确的有
(填标号)。
A.利用原电池反应判断金属活动性强弱不一
定准确
B.镁的金属性不一定比铝的金属性强
C.初中所学的金属活动性顺序已过时,没有实
用价值
D.电极不变,电解质溶液不同,电极反应也可
能不同
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。利用反应“Cu+2Ag+−
2Ag+Cu²+”设计原电池,该电池的负极发生
(填“氧化”或“还原”)反应,电解质
溶液是溶液。
(2)为了探究化学反应中的能量变化,某同学
设计了相同条件下如图甲、乙(铜、锌之间用导
线连接)所示的两个实验,反应一段时间后,可
观察到的现象错误的是(填标号)。

A.图甲和图乙中温度计示数均高于室温
B.反应相同时间时温度计示数:图甲>图乙
C.图甲和图乙只在锌棒表面产生气泡
D.产生气泡的速率:图乙>图甲
(3)[教材改编题.来源于教材P54第6题]某
同学利用原电池反应检测金属的活动性顺序,
设计了相同条件下如图丙、丁所示的两个实验。

①图丙中放电时H+向(填“镁片”或
“铝片”)移动。
②图丁中铝片为极,其电极反应式为
。
③依据该实验得出的下列结论中,正确的有
(填标号)。
A.利用原电池反应判断金属活动性强弱不一
定准确
B.镁的金属性不一定比铝的金属性强
C.初中所学的金属活动性顺序已过时,没有实
用价值
D.电极不变,电解质溶液不同,电极反应也可
能不同
答案:
(1) 氧化;$AgNO_3$
(2) C
(3) ① 铝片;② 负;$Al - 3e^- + 4OH^- = [Al(OH)_4]^-$;③ AD
(1) 氧化;$AgNO_3$
(2) C
(3) ① 铝片;② 负;$Al - 3e^- + 4OH^- = [Al(OH)_4]^-$;③ AD
查看更多完整答案,请扫码查看


