2025年教材帮高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年教材帮高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第20页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
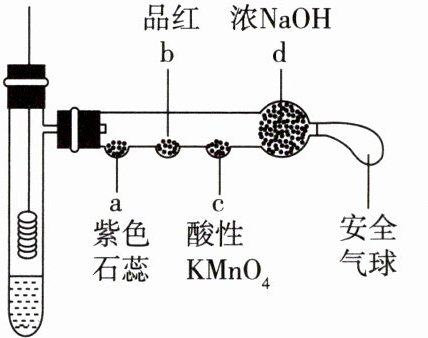
6.(2022广东卷)若将铜丝插入热浓硫酸中进行如图
(a~d均为浸有相应试液的棉花)所示的探究实验,下
列分析正确的是
A.Cu与浓硫酸反应,只体现H2SO4的酸性
B.a处变红,说明SO2是酸性氧化物
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H20生成
答案见第225页一考向3 (亚)硫酸盐的性质探究
例23(全国卷)绿矾是含有一定量结晶水的
硫酸亚铁,在工农业生产中具有重要的用途。
某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴
加KSCN溶液,溶液颜色无明显变化。再向试
管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管
(带两端开关K,和K2)(设为装置A)称重,记
为mg。将样品装入石英玻璃管中,再次将装
置A称重,记为m2g。按如图所示连接好装置
进行实验。
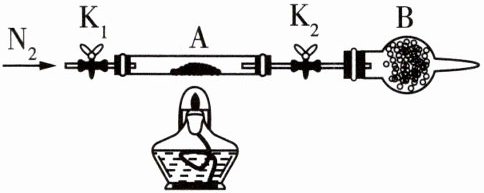
①仪器B的名称是
②将下列实验操作步骤正确排序
号);重复上述操作步骤,直至A恒重,记为
m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭
K,和K, d.打开K,和K2,缓缓通入N2
e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数
目x=
序操作,则使x
“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已
恒重的装置A接入如图所示的装置中,打开K,1
和K2,缓缓通入N2,加热。实验后反应管中残
留固体为红色粉末。
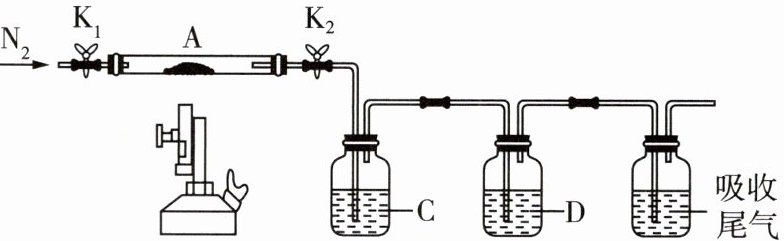
①C、D中的溶液依次为
D中有气泡冒出,并可观察到的现象分别为
a.品红 b.NaOH c.BaCl d.Ba(NO3)2
e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
(a~d均为浸有相应试液的棉花)所示的探究实验,下
列分析正确的是
A.Cu与浓硫酸反应,只体现H2SO4的酸性
B.a处变红,说明SO2是酸性氧化物
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H20生成
答案见第225页一考向3 (亚)硫酸盐的性质探究
例23(全国卷)绿矾是含有一定量结晶水的
硫酸亚铁,在工农业生产中具有重要的用途。
某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴
加KSCN溶液,溶液颜色无明显变化。再向试
管中通入空气,溶液逐渐变红。由此可知:
样品中没有Fe(III) Fe(II)易被氧气氧化为Fe(III)
。(2)为测定绿矾中结晶水含量,将石英玻璃管
(带两端开关K,和K2)(设为装置A)称重,记
为mg。将样品装入石英玻璃管中,再次将装
置A称重,记为m2g。按如图所示连接好装置
进行实验。

①仪器B的名称是
球形干燥管
。②将下列实验操作步骤正确排序
dabfce
(填标号);重复上述操作步骤,直至A恒重,记为
m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭
K,和K, d.打开K,和K2,缓缓通入N2
e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数
目x=
$\frac{76(m_{2}-m_{1})}{9(m_{3}-m_{1})}$
(列式表示)。若实验时按a、d次序操作,则使x
偏小
(填“偏大”“偏小”或
“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已
恒重的装置A接入如图所示的装置中,打开K,1
和K2,缓缓通入N2,加热。实验后反应管中残
留固体为红色粉末。

①C、D中的溶液依次为
c、a
(填标号)。C、D中有气泡冒出,并可观察到的现象分别为
生成白色沉淀、溶液褪色
。a.品红 b.NaOH c.BaCl d.Ba(NO3)2
e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
$2FeSO_{4}\xlongequal{高温}Fe_{2}O_{3} + SO_{2}\uparrow + SO_{3}\uparrow$
。
答案:
6.B $Cu$与浓硫酸反应生成$CuSO_{4}$、$SO_{2}$和$H_{2}O$,体现了$H_{2}SO_{4}$的酸性和氧化性,A项错误;能使紫色石蕊变红,说明有酸性物质生成,$SO_{2}$是酸性氧化物,B项正确;c处酸性$KMnO_{4}$褪色,体现了$SO_{2}$的还原性,C项错误;$Cu$与浓硫酸反应有$H_{2}O$生成,反应后混合液中硫酸浓度很大,浓硫酸吸水,导致生成无水$CuSO_{4}$,故在试管底部出现白色固体,D项错误。
(1)样品中没有Fe(III) Fe(II)易被氧气氧化为Fe(III)
(2)①球形干燥管 ②dabfce
③$\frac{76(m_{2}-m_{1})}{9(m_{3}-m_{1})}$ 偏小
(3)①c、a 生成白色沉淀、溶液褪色 ②$2FeSO_{4}\xlongequal{高温}Fe_{2}O_{3} + SO_{2}\uparrow + SO_{3}\uparrow$
(1)样品中没有Fe(III) Fe(II)易被氧气氧化为Fe(III)
(2)①球形干燥管 ②dabfce
③$\frac{76(m_{2}-m_{1})}{9(m_{3}-m_{1})}$ 偏小
(3)①c、a 生成白色沉淀、溶液褪色 ②$2FeSO_{4}\xlongequal{高温}Fe_{2}O_{3} + SO_{2}\uparrow + SO_{3}\uparrow$
例23(全国卷)绿矾是含有一定量结晶水的
硫酸亚铁,在工农业生产中具有重要的用途。
某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴
加KSCN溶液,溶液颜色无明显变化。再向试
管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管
(带两端开关K,和K2)(设为装置A)称重,记
为mg。将样品装入石英玻璃管中,再次将装
置A称重,记为m2g。按如图所示连接好装置
进行实验。

①仪器B的名称是
②将下列实验操作步骤正确排序
号);重复上述操作步骤,直至A恒重,记为
m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭
K,和K, d.打开K,和K2,缓缓通入N2
e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数
目x=
序操作,则使x

“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已
恒重的装置A接入如图所示的装置中,打开K,1
和K2,缓缓通入N2,加热。实验后反应管中残
留固体为红色粉末。

①C、D中的溶液依次为
D中有气泡冒出,并可观察到的现象分别为
a.品红 b.NaOH c.BaCl d.Ba(NO3)2
e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
硫酸亚铁,在工农业生产中具有重要的用途。
某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴
加KSCN溶液,溶液颜色无明显变化。再向试
管中通入空气,溶液逐渐变红。由此可知:
样品中没有Fe(III) Fe(II)易被氧气氧化为Fe(III)
。(2)为测定绿矾中结晶水含量,将石英玻璃管
(带两端开关K,和K2)(设为装置A)称重,记
为mg。将样品装入石英玻璃管中,再次将装
置A称重,记为m2g。按如图所示连接好装置
进行实验。

①仪器B的名称是
球形干燥管
。②将下列实验操作步骤正确排序
dabfce
(填标号);重复上述操作步骤,直至A恒重,记为
m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭
K,和K, d.打开K,和K2,缓缓通入N2
e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数
目x=
$\frac{76(m_{2}-m_{1})}{9(m_{3}-m_{1})}$
(列式表示)。若实验时按a、d次序操作,则使x
偏小
(填“偏大”“偏小”或
“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已
恒重的装置A接入如图所示的装置中,打开K,1
和K2,缓缓通入N2,加热。实验后反应管中残
留固体为红色粉末。

①C、D中的溶液依次为
c、a
(填标号)。C、D中有气泡冒出,并可观察到的现象分别为
生成白色沉淀、溶液褪色
。a.品红 b.NaOH c.BaCl d.Ba(NO3)2
e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
$2FeSO_{4}\xlongequal{高温}Fe_{2}O_{3} + SO_{2}\uparrow + SO_{3}\uparrow$
。
答案:
(1)样品中没有Fe(III) Fe(II)易被氧气氧化为Fe(III)
(2)①球形干燥管 ②dabfce
③$\frac{76(m_{2}-m_{1})}{9(m_{3}-m_{1})}$ 偏小
(3)①c、a 生成白色沉淀、溶液褪色 ②$2FeSO_{4}\xlongequal{高温}Fe_{2}O_{3} + SO_{2}\uparrow + SO_{3}\uparrow$
(1)样品中没有Fe(III) Fe(II)易被氧气氧化为Fe(III)
(2)①球形干燥管 ②dabfce
③$\frac{76(m_{2}-m_{1})}{9(m_{3}-m_{1})}$ 偏小
(3)①c、a 生成白色沉淀、溶液褪色 ②$2FeSO_{4}\xlongequal{高温}Fe_{2}O_{3} + SO_{2}\uparrow + SO_{3}\uparrow$
查看更多完整答案,请扫码查看


