2025年教材帮高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年教材帮高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
子题3[新趋势.学科融合|利用沸点与气
压关系的化学实验3(2024吉林长春外国语
学校月考)如图所示,止水夹开始处于关闭
状态,将液体A滴入试管②与气体B充分反
应,打开止水夹,发现试管①内的水立刻沸
腾了,则液体A和气体B的组合不可能是
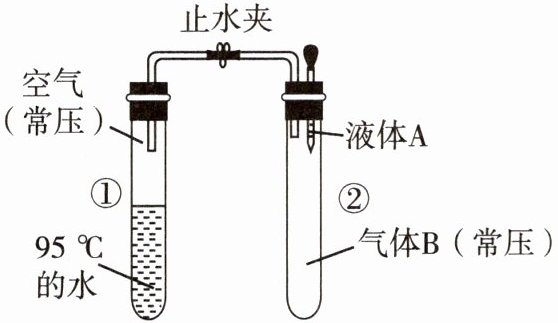
A.Na2SO3溶液、Cl2
B.水、NO
C.水、NO2
D.NaOH溶液、CO2
压关系的化学实验3(2024吉林长春外国语
学校月考)如图所示,止水夹开始处于关闭
状态,将液体A滴入试管②与气体B充分反
应,打开止水夹,发现试管①内的水立刻沸
腾了,则液体A和气体B的组合不可能是

A.Na2SO3溶液、Cl2
B.水、NO
C.水、NO2
D.NaOH溶液、CO2
答案:
B破题思路》在不加热情况下,密闭试管①中95℃的水
能沸腾,说明水面上空气的压强减小,即试管②中液
根据物理知识,压强减小会使液体的沸点降低
体A与气体B充分反应后气体减少,压强减小,这样
打开止水夹后,试管①中压强才会减小。
解析》Na2SO3溶液能吸收Cl2,发生氧化还原反应
SO;−+Cl+H20=SO;−+2CI+2H,试管②中气
体减少,A项可能;NO与水不发生化学反应,装置内
的压强不变,水不会沸腾,B项不可能;NO2与H2O发
生反应3NO2+H20==2HNO+NO,试管②中的气
体减少,C项可能;NaOH溶液能吸收CO2,试管②中
的气体减少,D项可能。
能沸腾,说明水面上空气的压强减小,即试管②中液
根据物理知识,压强减小会使液体的沸点降低
体A与气体B充分反应后气体减少,压强减小,这样
打开止水夹后,试管①中压强才会减小。
解析》Na2SO3溶液能吸收Cl2,发生氧化还原反应
SO;−+Cl+H20=SO;−+2CI+2H,试管②中气
体减少,A项可能;NO与水不发生化学反应,装置内
的压强不变,水不会沸腾,B项不可能;NO2与H2O发
生反应3NO2+H20==2HNO+NO,试管②中的气
体减少,C项可能;NaOH溶液能吸收CO2,试管②中
的气体减少,D项可能。
例202.56g铜粉与10mL浓
硝酸反应,当铜粉完全反应时
收集到气体0.896L(已换算成
标准状况,不考虑NO2与N204
化),则所消耗硝酸的物质的量是多少?
硝酸反应,当铜粉完全反应时
收集到气体0.896L(已换算成
标准状况,不考虑NO2与N204
化),则所消耗硝酸的物质的量是多少?
答案:
0.12mol
解析'n(Cu)=6.42g..56mgol|−!=0.04mol,n(气体)=
$\frac{0.896L}{22.4L.mol−}$=0.04mol。由Cu与浓硝酸反应的化学
方程式Cu+4HNO(浓)==Cu(NO)2+2NO2↑+2H20 可知,0.04molCu完全反应理论上应生成0.08mol NO2,但实际只生成0.04mol,说明还有NO生成。硝酸反HN应O后3的,物N质元的素量存等在于于这Cu几(N种O物3)质2、N中ON2和原N子O的中物,故质一消的耗量之和,则n涓耗(HNO)=2n[Cu(NO3)2]+n(NO2)+
原子守恒
n(NO)=2n(Cu)+n(气体)=2×0.04mol+0.04mol1=
0.12mol。
答案0.12mol
解析'n(Cu)=6.42g..56mgol|−!=0.04mol,n(气体)=
$\frac{0.896L}{22.4L.mol−}$=0.04mol。由Cu与浓硝酸反应的化学
方程式Cu+4HNO(浓)==Cu(NO)2+2NO2↑+2H20 可知,0.04molCu完全反应理论上应生成0.08mol NO2,但实际只生成0.04mol,说明还有NO生成。硝酸反HN应O后3的,物N质元的素量存等在于于这Cu几(N种O物3)质2、N中ON2和原N子O的中物,故质一消的耗量之和,则n涓耗(HNO)=2n[Cu(NO3)2]+n(NO2)+
原子守恒
n(NO)=2n(Cu)+n(气体)=2×0.04mol+0.04mol1=
0.12mol。
答案0.12mol
子题I1在母题基础上,若反应后溶液中H+
的物质的量为αmol,则溶液中NO的物质
的量是多少?
的物质的量为αmol,则溶液中NO的物质
的量是多少?
答案:
(a+0.08)mol解析》反应后溶液中存在H、Cu²+、NO,根据电荷
守恒可得:n(NO)=n(H+)+2n(Cu²+)=amol+
2×0.04mol=(a+0.08)mol。
答案(a+0.08)mol
守恒可得:n(NO)=n(H+)+2n(Cu²+)=amol+
2×0.04mol=(a+0.08)mol。
答案(a+0.08)mol
子题2在母题基础上,若向反应后的溶液
中加入100mL1mol.L−NaOH溶液,恰好
使Cu²+完全沉淀,求原硝酸的浓度是多少?
中加入100mL1mol.L−NaOH溶液,恰好
使Cu²+完全沉淀,求原硝酸的浓度是多少?
答案:
14mol·L⁻¹解析》[思路分析]
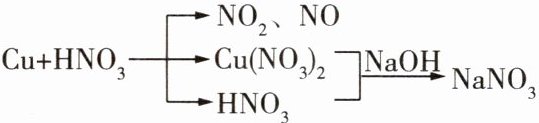
因此原硝酸中N原子的物质的量应等于生成的气体
中N原子的物质的量与NaNO中N原子的物质的量
之和,即n(HNO)=n(NaNO)+n(气体)=n(NaOH)+
n(气体)=0.1Lx1mol.L−+0.04mol=0.14mol1,
故c(HNO3)=$\frac{0.14mol}{0.01L}$=14mol.L−。
答案'14mol.L−
14mol·L⁻¹解析》[思路分析]
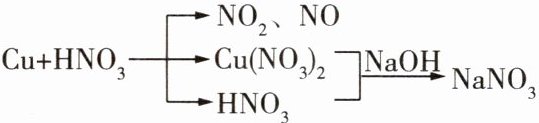
因此原硝酸中N原子的物质的量应等于生成的气体
中N原子的物质的量与NaNO中N原子的物质的量
之和,即n(HNO)=n(NaNO)+n(气体)=n(NaOH)+
n(气体)=0.1Lx1mol.L−+0.04mol=0.14mol1,
故c(HNO3)=$\frac{0.14mol}{0.01L}$=14mol.L−。
答案'14mol.L−
查看更多完整答案,请扫码查看


