第61页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
1.(2024·内蒙古)下图是甲、乙两物质在一定条件下反应的示意图,下列说法不正确的是( )
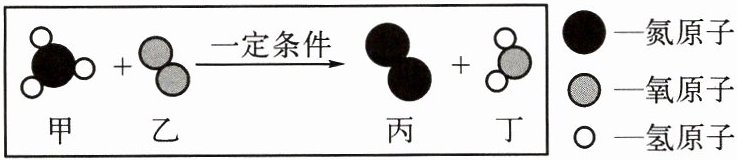
A.该反应前后原子数目不变
B.该反应前后共有两种化合物
C.参加反应的甲和乙分子个数比为 2∶3
D.反应生成的丙和丁质量比为 14∶27

A.该反应前后原子数目不变
B.该反应前后共有两种化合物
C.参加反应的甲和乙分子个数比为 2∶3
D.反应生成的丙和丁质量比为 14∶27
答案:
C 提示:由图可知,甲为NH₃、乙为O₂、丙为N₂、丁为H₂O,反应的化学方程式为4NH₃+3O₂ 一定条件2N₂+6H₂O。化学反应前后原子的种类和数目不变;化合物是指含有两种或两种以上元素的纯净物,则甲、丁属于化合物;由化学方程式可知,参加反应的甲和乙分子个数比为4:3;反应生成的丙和丁质量比为(14×2×2):[(1×2+16)×6]=14:27。
2. 镁在氧气中燃烧后生成氧化镁,反应中镁、氧气、氧化镁的质量比为( )
A.2∶1∶2
B.24∶32∶40
C.48∶32∶80
D.48∶32∶40
A.2∶1∶2
B.24∶32∶40
C.48∶32∶80
D.48∶32∶40
答案:
C 提示:根据化学方程式2Mg+O₂点燃2MgO可知,镁、氧气、氧化镁质量比为(24×2):(16×2):[2×(24+16)]=48:32:80。
3.(2024·贵州)我国重载铁路加氢站今年投入了商业运营。机车加注 80 kg 氢气做燃料,若用电解水的方法制取这些氢气,理论上需要水的质量是多少?(写出计算过程)
答案:
解:设理论上需要水的质量是x。
2H₂O通电2H₂↑+O₂↑
36 4
x 80kg
36/4=x/80kg
解得:x=720kg。
答:理论上需要水的质量是720kg。
2H₂O通电2H₂↑+O₂↑
36 4
x 80kg
36/4=x/80kg
解得:x=720kg。
答:理论上需要水的质量是720kg。
4. 我国明代科技著作《天工开物》中有利用炉甘石(主要成分是 $ZnCO_3$)火法炼锌的工艺记载,主要反应原理为 $ZnCO_3 + 2C \xlongequal{高温} Zn + 3CO \uparrow$。现用 200 kg 炉甘石与足量碳充分反应,产生 CO 的质量与加热时间的关系如图所示。

(1)此过程中产生 CO 的质量是______kg。
(2)计算此炉甘石中 $ZnCO_3$ 的质量分数。

(1)此过程中产生 CO 的质量是______kg。
(2)计算此炉甘石中 $ZnCO_3$ 的质量分数。
答案:
(1)84
(2)解:设炉甘石中碳酸锌的质量为x。
ZnCO₃+2C高温Zn+3CO↑
125 84
x 84kg
125/84=x/84kg
解得:x=125kg。
此炉甘石中ZnCO₃的质量分数为125kg/200kg×100%=62.5%。
答:此炉甘石中ZnCO₃的质量分数为62.5%。
(1)84
(2)解:设炉甘石中碳酸锌的质量为x。
ZnCO₃+2C高温Zn+3CO↑
125 84
x 84kg
125/84=x/84kg
解得:x=125kg。
此炉甘石中ZnCO₃的质量分数为125kg/200kg×100%=62.5%。
答:此炉甘石中ZnCO₃的质量分数为62.5%。
5. 7.2 g 镁粉和铝粉的混合物与足量氧气充分反应,得到的氧化物质量可能为( )
A.10.6 g
B.12.0 g
C.13.0 g
D.13.6 g
A.10.6 g
B.12.0 g
C.13.0 g
D.13.6 g
答案:
C 提示:镁、铝分别与氧气反应生成MgO和Al₂O₃;根据化学方程式计算,7.2gMg可生成12gMgO,7.2gAl可生成13.6gAl₂O₃,故7.2g镁粉和铝粉的混合物与足量氧气充分反应后,得到的氧化物质量应在12g和13.6g之间。
6. 工业上,高温煅烧石灰石可制取生石灰($CaCO_3 \xlongequal{高温} CaO + CO_2 \uparrow$)。现有 100 g $CaCO_3$ 样品,高温煅烧一段时间后,剩余固体的质量为 67 g。下列推断不符合客观事实的是( )
A.生成 $CO_2$ 的质量是 33 g
B.生成物中 CaO 的质量是 42 g
C.剩余固体中钙元素的质量分数大于 40%
D.剩余固体中碳元素与氧元素的质量之比大于 1∶4
A.生成 $CO_2$ 的质量是 33 g
B.生成物中 CaO 的质量是 42 g
C.剩余固体中钙元素的质量分数大于 40%
D.剩余固体中碳元素与氧元素的质量之比大于 1∶4
答案:
D 提示:根据质量守恒定律,二氧化碳的质量为100g−67g=33g。设生成CaO的质量为x。
CaCO₃高温CaO+CO₂↑
56 44
x 33g
56/44=x/33g
解得:x=42g。
反应前后的钙元素质量不变,钙元素质量为100g×(40/100×100%)=40g,则剩余固体中钙元素的质量分数为40g/67g×100%≈59.7%>40%。剩余的固体中氧化钙为42g,碳酸钙为67g−42g=25g,则剩余固体中碳元素的质量为25g×(12/100×100%)=3g,氧元素的质量为67g−3g−40g=24g,两者质量之比为3g:24g=1:8<1:4。
CaCO₃高温CaO+CO₂↑
56 44
x 33g
56/44=x/33g
解得:x=42g。
反应前后的钙元素质量不变,钙元素质量为100g×(40/100×100%)=40g,则剩余固体中钙元素的质量分数为40g/67g×100%≈59.7%>40%。剩余的固体中氧化钙为42g,碳酸钙为67g−42g=25g,则剩余固体中碳元素的质量为25g×(12/100×100%)=3g,氧元素的质量为67g−3g−40g=24g,两者质量之比为3g:24g=1:8<1:4。
7. 我们的祖先很早就掌握了炼铜的工艺,他们将孔雀石[主要成分是 $Cu_2(OH)_2CO_3$]和木炭一起加热就可得到红色的铜。兴趣小组为测定某孔雀石中 $Cu_2(OH)_2CO_3$ 的质量分数,进行如下实验:称取 25 g 孔雀石样品,粉碎后放入烧杯,向其中加入 200 g 稀硫酸(过量),充分反应后称量,烧杯内物质的总质量为 220.6 g(假设杂质都不与稀硫酸发生反应)。
(1)$Cu_2(OH)_2CO_3 + 2H_2SO_4 \xlongequal{} 2CuSO_4 + CO_2 \uparrow + 3$______。
(2)生成气体的质量是______g。
(3)求该孔雀石中 $Cu_2(OH)_2CO_3$ 的质量分数。(写出计算过程)
(1)$Cu_2(OH)_2CO_3 + 2H_2SO_4 \xlongequal{} 2CuSO_4 + CO_2 \uparrow + 3$______。
(2)生成气体的质量是______g。
(3)求该孔雀石中 $Cu_2(OH)_2CO_3$ 的质量分数。(写出计算过程)
答案:
(1)H₂O
(2)4.4
(3)解:设孔雀石中Cu₂(OH)₂CO₃的质量为x。
Cu₂(OH)₂CO₃+2H₂SO₄=2CuSO₄+CO₂↑+3H₂O
222 44
x 4.4g
222/44=x/4.4g
解得:x=22.2g。
则孔雀石中Cu₂(OH)₂CO₃的质量分数为22.2g/25g×100%=88.8%。
答:孔雀石中Cu₂(OH)₂CO₃的质量分数为88.8%。
提示:
(2)根据质量守恒定律可知,产生气体质量为25g+200g−220.6g=4.4g。
(1)H₂O
(2)4.4
(3)解:设孔雀石中Cu₂(OH)₂CO₃的质量为x。
Cu₂(OH)₂CO₃+2H₂SO₄=2CuSO₄+CO₂↑+3H₂O
222 44
x 4.4g
222/44=x/4.4g
解得:x=22.2g。
则孔雀石中Cu₂(OH)₂CO₃的质量分数为22.2g/25g×100%=88.8%。
答:孔雀石中Cu₂(OH)₂CO₃的质量分数为88.8%。
提示:
(2)根据质量守恒定律可知,产生气体质量为25g+200g−220.6g=4.4g。
查看更多完整答案,请扫码查看


