第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
1.(2024·重庆)借助模型可以更好地认识物质的微观构成。下列模型可以用来表示“HCl”的是( )
A
B
C
D

A
B
C
D

答案:
D 提示:一个氯化氢分子是由两个不同原子构成的,因为氯原子半径大于氢原子半径,因此,可用大圆代表氯原子,小圆代表氢原子。
2.(2024·德阳旌阳期中)建立模型是学习化学的重要方法。下列有关模型正确的是( )
 A
A
B
C
D
 A
A B
C
D
答案:
D 提示:地壳中元素含量由多到少前四种元素:氧、硅、铝、铁;氧离子和氧原子都属于氧元素;宏观上物质是由元素组成的,微观上物质是由分子、原子和离子构成的;钠原子失去电子变成钠离子,钠离子得到电子变回钠原子。
3.(2024·青岛)科学家运用了模型建构的方法探索原子的结构。下列对原子结构模型演变过程的认识,不正确的是( )
 A. 道尔顿认为原子是不可再分的实心球,是构成物质的最小粒子
A. 道尔顿认为原子是不可再分的实心球,是构成物质的最小粒子
B. 汤姆孙等人在原子中发现了电子,推翻了道尔顿实心球模型
C. 卢瑟福等人通过α粒子散射实验修正了汤姆孙葡萄干布丁模型
D. 卢瑟福核式模型是最完善的原子结构模型,不会被替代
 A. 道尔顿认为原子是不可再分的实心球,是构成物质的最小粒子
A. 道尔顿认为原子是不可再分的实心球,是构成物质的最小粒子 B. 汤姆孙等人在原子中发现了电子,推翻了道尔顿实心球模型
C. 卢瑟福等人通过α粒子散射实验修正了汤姆孙葡萄干布丁模型
D. 卢瑟福核式模型是最完善的原子结构模型,不会被替代
答案:
D 提示:道尔顿是探索原子结构较早的科学家,受当时科学水平的局限性,道尔顿认为原子是“不可再分的实心球体”,是构成物质的最小粒子;由于汤姆孙等人在原子中发现了电子,提出汤姆孙葡萄干布丁模型,推翻了道尔顿实心球模型;英国物理学家卢瑟福设计了α粒子散射实验,得出卢瑟福核式模型,修正了汤姆孙关于原子结构的汤姆孙葡萄干布丁模型;卢瑟福核式模型也不是最完善的原子结构模型,将会被替代,人类对原子结构的认识永无止境。
4. 人类对微观世界的探究永无止境。
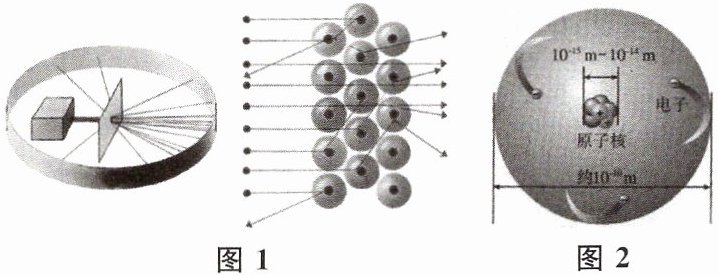
(1)道尔顿提出的原子学说认为原子是不可再分的实心球体。这个观点现在看来是______(填“正确”或“错误”)的。
(2)卢瑟福用α粒子轰击金箔后产生散射现象,如图1所示,在分析实验结果的基础上,他提出了原子结构模型,如图2所示。卢瑟福这一研究是______(填字母)的过程。
a. 建立模型 b. 得出结论 c. 提出问题 d. 验证证据
(3)卢瑟福在α粒子(α粒子带正电荷)散射实验中,推断原子中绝大部分空间是空的,他的依据是______。
(4)卢瑟福的原子结构模型:原子是由原子核和核外电子构成的,原子核带______电荷。
(5)中国科学家利用超强超短激光成功获得“反物质”,“反物质”由“反粒子”构成,“反粒子”与其对应的“正粒子”具有相同的质量与电量,但电性相反。已知α粒子的符号是$_{2}^{4}He^{2+}$,则反α粒子的符号可以表示为______。

(1)道尔顿提出的原子学说认为原子是不可再分的实心球体。这个观点现在看来是______(填“正确”或“错误”)的。
(2)卢瑟福用α粒子轰击金箔后产生散射现象,如图1所示,在分析实验结果的基础上,他提出了原子结构模型,如图2所示。卢瑟福这一研究是______(填字母)的过程。
a. 建立模型 b. 得出结论 c. 提出问题 d. 验证证据
(3)卢瑟福在α粒子(α粒子带正电荷)散射实验中,推断原子中绝大部分空间是空的,他的依据是______。
(4)卢瑟福的原子结构模型:原子是由原子核和核外电子构成的,原子核带______电荷。
(5)中国科学家利用超强超短激光成功获得“反物质”,“反物质”由“反粒子”构成,“反粒子”与其对应的“正粒子”具有相同的质量与电量,但电性相反。已知α粒子的符号是$_{2}^{4}He^{2+}$,则反α粒子的符号可以表示为______。
答案:
(1)错误
(2)a
(3)绝大多数α粒子通过金箔并按原来方向运动
(4)正
(5)${}_{2}^{4}He^{2-}$
提示:
(1)原子由居于原子中心的原子核及核外电子构成,原子核外是一个空旷的区域。道尔顿提出的原子学说认为原子是不可再分的实心球体,这个观点现在看来是错误的。
(2)卢瑟福用α粒子轰击金箔后产生散射现象,在分析实验结果的基础上,他提出了原子结构模型。卢瑟福这一研究是建立模型的过程。
(3)卢瑟福在α粒子(α粒子带正电荷)散射实验中,发现绝大多数α粒子通过金箔并按原来方向运动,推断原子中绝大部分空间是空的。
(5)α粒子的符号是${}_{2}^{4}He^{2+}$,该粒子的质子数为2,相对原子质量为4,带有2个单位的正电荷,则反α粒子的质子数为2,相对原子质量为4,带2个单位负电荷,符号可以表示为${}_{2}^{4}He^{2-}$。
(1)错误
(2)a
(3)绝大多数α粒子通过金箔并按原来方向运动
(4)正
(5)${}_{2}^{4}He^{2-}$
提示:
(1)原子由居于原子中心的原子核及核外电子构成,原子核外是一个空旷的区域。道尔顿提出的原子学说认为原子是不可再分的实心球体,这个观点现在看来是错误的。
(2)卢瑟福用α粒子轰击金箔后产生散射现象,在分析实验结果的基础上,他提出了原子结构模型。卢瑟福这一研究是建立模型的过程。
(3)卢瑟福在α粒子(α粒子带正电荷)散射实验中,发现绝大多数α粒子通过金箔并按原来方向运动,推断原子中绝大部分空间是空的。
(5)α粒子的符号是${}_{2}^{4}He^{2+}$,该粒子的质子数为2,相对原子质量为4,带有2个单位的正电荷,则反α粒子的质子数为2,相对原子质量为4,带2个单位负电荷,符号可以表示为${}_{2}^{4}He^{2-}$。
5. 为了深入地认识物质,初步理解化学现象的本质,兴趣小组以“构建微观模型”为主题开展项目式学习。
【任务一】认识水分子,构建分子模型。
(1)探究水的组成。18世纪末,英国科学家普利斯特里将“易燃空气”(即氢气)与空气混合后盛在干燥的玻璃瓶中,当用电火花引爆,发现瓶底有无色液体产生。后来,法国科学家拉瓦锡让水在高温下通过一根烧红的铁管(Fe),得到“易燃空气”。至此,水是由氢、氧两种元素组成的这一观点得到了化学界的公认。
①在探究水的组成过程中,普利斯特里利用的是______(填反应类型)。
②拉瓦锡所做实验中除了得到“易燃空气”外,还有四氧化三铁生成。写出该反应的文字表达式:______。
(2)模拟水的分解和化合过程,构建分子模型。已知同温同压下,两种气体的体积之比等于其所含的分子个数之比。兴趣小组利用不同的小球分别表示氢原子和氧原子,对电解水反应的微观过程提出了如下图所示的猜想:

同温同压下,1体积氮气和3体积氢气在催化剂作用下化合生成2体积氨气( )。请在下图的框中用模型模拟该反应的微观过程。
□

氮气与氢气反应的示意图

【任务二】构建原子模型,认识物质组成规律。
(3)原子的构成。兴趣小组经查阅资料,发现6种原子的构成如下表所示。
|原子种类|质子数|中子数|核外电子数|
|H-1|1|0|1|
|H-2|1|1|1|
|H-3|1|2|1|
|O-16|8|8|8|
|O-17|8|9|8|
|O-18|8|10|8|

①1个C-14原子中含有______个中子。
②表中的三种H原子和O-16原子最多可构成______种水分子。
③基于上述资料,你能得到的合理推论是______。
(4)原子中核外电子的排布规律。右图表示铁原子的结构示意图, x= ______。

【任务三】探究元素与物质组成的奥秘。
(5)从元素和化合价的角度认识物质。高铁酸钾$(K_2FeO_4)$是一种新型高效绿色消毒剂,高铁酸钾中铁元素的化合价为______。
(6)探索元素质量与物质质量的关系。尿素$[CO(NH_2)_2]$是农业生产中常用的化肥之一,市场价格为1080元/t。现用32400元采购尿素,则购得的尿素中含______t氮元素。
【任务一】认识水分子,构建分子模型。
(1)探究水的组成。18世纪末,英国科学家普利斯特里将“易燃空气”(即氢气)与空气混合后盛在干燥的玻璃瓶中,当用电火花引爆,发现瓶底有无色液体产生。后来,法国科学家拉瓦锡让水在高温下通过一根烧红的铁管(Fe),得到“易燃空气”。至此,水是由氢、氧两种元素组成的这一观点得到了化学界的公认。
①在探究水的组成过程中,普利斯特里利用的是______(填反应类型)。
②拉瓦锡所做实验中除了得到“易燃空气”外,还有四氧化三铁生成。写出该反应的文字表达式:______。
(2)模拟水的分解和化合过程,构建分子模型。已知同温同压下,两种气体的体积之比等于其所含的分子个数之比。兴趣小组利用不同的小球分别表示氢原子和氧原子,对电解水反应的微观过程提出了如下图所示的猜想:

同温同压下,1体积氮气和3体积氢气在催化剂作用下化合生成2体积氨气( )。请在下图的框中用模型模拟该反应的微观过程。
□

氮气与氢气反应的示意图

【任务二】构建原子模型,认识物质组成规律。
(3)原子的构成。兴趣小组经查阅资料,发现6种原子的构成如下表所示。
|原子种类|质子数|中子数|核外电子数|
|H-1|1|0|1|
|H-2|1|1|1|
|H-3|1|2|1|
|O-16|8|8|8|
|O-17|8|9|8|
|O-18|8|10|8|

①1个C-14原子中含有______个中子。
②表中的三种H原子和O-16原子最多可构成______种水分子。
③基于上述资料,你能得到的合理推论是______。
(4)原子中核外电子的排布规律。右图表示铁原子的结构示意图, x= ______。

【任务三】探究元素与物质组成的奥秘。
(5)从元素和化合价的角度认识物质。高铁酸钾$(K_2FeO_4)$是一种新型高效绿色消毒剂,高铁酸钾中铁元素的化合价为______。
(6)探索元素质量与物质质量的关系。尿素$[CO(NH_2)_2]$是农业生产中常用的化肥之一,市场价格为1080元/t。现用32400元采购尿素,则购得的尿素中含______t氮元素。
答案:
(1)化合反应 水+铁$\xrightarrow{高温}$氢气+四氧化三铁
(2)
(3)①8 ②6 ③同种元素的原子中,质子数相同,中子数可能不同
(4)14
(5)+6
(6)14
提示:
(3)①1个C - 14原子中含有6个质子,相对原子质量为14,则含有14 - 6 = 8个中子。②表中的三种H原子有6种组合H - 1和H - 1、H - 2和H - 2、H - 3和H - 3、H - 1和H - 2、H - 1和H - 3、H - 2和H - 3,和O - 16原子最多可构成6种水分子。
(5)高铁酸钾($K_{2}FeO_{4}$)中K元素的化合价为+1,O元素的化合价为 - 2,设铁元素的化合价为x,根据在化合物中正负化合价代数和为0,可知(+1)×2 + x + (-2)×4 = 0,解得x = +6。
(6)购得的尿素中含有氮元素的质量=$\frac{32400元}{1080元/t}× \frac{14× 2}{12+16+14× 2+1× 4}× 100\%=14 t$。
(1)化合反应 水+铁$\xrightarrow{高温}$氢气+四氧化三铁
(2)

(3)①8 ②6 ③同种元素的原子中,质子数相同,中子数可能不同
(4)14
(5)+6
(6)14
提示:
(3)①1个C - 14原子中含有6个质子,相对原子质量为14,则含有14 - 6 = 8个中子。②表中的三种H原子有6种组合H - 1和H - 1、H - 2和H - 2、H - 3和H - 3、H - 1和H - 2、H - 1和H - 3、H - 2和H - 3,和O - 16原子最多可构成6种水分子。
(5)高铁酸钾($K_{2}FeO_{4}$)中K元素的化合价为+1,O元素的化合价为 - 2,设铁元素的化合价为x,根据在化合物中正负化合价代数和为0,可知(+1)×2 + x + (-2)×4 = 0,解得x = +6。
(6)购得的尿素中含有氮元素的质量=$\frac{32400元}{1080元/t}× \frac{14× 2}{12+16+14× 2+1× 4}× 100\%=14 t$。
查看更多完整答案,请扫码查看


