第31页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
7. 科学课堂上,同学们进行了以铜为主要原料制备硫酸铜的最优途径的探究。同学们经过热烈讨论给出了以下几种方案,请你从原理的可行性、原料利用率的高低、生产流程复杂程度、生产成本、对环境的污染程度等角度分析讨论这些方案,并选出最优途径(方案都使用化学方程式表达)。
(1)评价方案:
[方案1]:$Cu+H_{2}SO_{4}= CuSO_{4}+H_{2}\uparrow $。评价:
[方案2]:$Cu+2H_{2}SO_{4}(浓)\xlongequal {△}CuSO_{4}+SO_{2}+2H_{2}O$。评价:
[方案3]:$2Cu+O_{2}\xlongequal {△}2CuO;CuO+H_{2}SO_{4}= CuSO_{4}+H_{2}O$。评价:
[方案4]:$Cu+Ag_{2}SO_{4}= CuSO_{4}+2Ag$。评价:
[方案5]:$Cu+FeSO_{4}= CuSO_{4}+Fe$。评价:
[方案6]:$Cu+2AgNO_{3}= Cu(NO_{3})_{2}+2Ag;Cu(NO_{3})_{2}+2NaOH= Cu(OH)_{2}\downarrow +2NaNO_{3};Cu(OH)_{2}+H_{2}SO_{4}= CuSO_{4}+2H_{2}O$。评价:
(2)你认为最优的方案为
(1)评价方案:
[方案1]:$Cu+H_{2}SO_{4}= CuSO_{4}+H_{2}\uparrow $。评价:
不能进行反应,铜的金属活动性在氢之后
。[方案2]:$Cu+2H_{2}SO_{4}(浓)\xlongequal {△}CuSO_{4}+SO_{2}+2H_{2}O$。评价:
产生有毒气体二氧化硫,有可能污染环境,要处理废气,会增加成本
。[方案3]:$2Cu+O_{2}\xlongequal {△}2CuO;CuO+H_{2}SO_{4}= CuSO_{4}+H_{2}O$。评价:
原理正确,流程比较简单,没有污染物生成,比较适合
。[方案4]:$Cu+Ag_{2}SO_{4}= CuSO_{4}+2Ag$。评价:
硫酸银溶解度小,反应较为缓慢,原料价格高,且Ag₂SO₄剩余可能导致重金属污染
。[方案5]:$Cu+FeSO_{4}= CuSO_{4}+Fe$。评价:
不能进行反应,铜的金属活动性在铁之后
。[方案6]:$Cu+2AgNO_{3}= Cu(NO_{3})_{2}+2Ag;Cu(NO_{3})_{2}+2NaOH= Cu(OH)_{2}\downarrow +2NaNO_{3};Cu(OH)_{2}+H_{2}SO_{4}= CuSO_{4}+2H_{2}O$。评价:
步骤复杂,原料价格高,且AgNO₃剩余可能导致重金属污染
。(2)你认为最优的方案为
方案3
。
答案:
(1)[方案1]:不能进行反应,铜的金属活动性在氢之后
[方案2]:产生有毒气体二氧化硫,有可能污染环境,要处理废气,会增加成本
[方案3]:原理正确,流程比较简单,没有污染物生成,比较适合
[方案4]:硫酸银溶解度小,反应较为缓慢,原料价格高,且Ag₂SO₄剩余可能导致重金属污染
[方案5]:不能进行反应,铜的金属活动性在铁之后
[方案6]:步骤复杂,原料价格高,且AgNO₃剩余可能导致重金属污染
(2)方案3
[方案2]:产生有毒气体二氧化硫,有可能污染环境,要处理废气,会增加成本
[方案3]:原理正确,流程比较简单,没有污染物生成,比较适合
[方案4]:硫酸银溶解度小,反应较为缓慢,原料价格高,且Ag₂SO₄剩余可能导致重金属污染
[方案5]:不能进行反应,铜的金属活动性在铁之后
[方案6]:步骤复杂,原料价格高,且AgNO₃剩余可能导致重金属污染
(2)方案3
8. 人们的生活、生产与材料息息相关,下列说法正确的是 (
A.复旦大学研究的能导电、存储的二维材料二硫化钼是一种新型有机功能材料
B.中国天眼用到碳化硅,电子芯片用到二氧化硅
C.歼-20上用到的氮化镓材料属于金属合金材料
D.我国自主研发的JD-1紫外光固化树脂属于有机合成材料
D
)A.复旦大学研究的能导电、存储的二维材料二硫化钼是一种新型有机功能材料
B.中国天眼用到碳化硅,电子芯片用到二氧化硅
C.歼-20上用到的氮化镓材料属于金属合金材料
D.我国自主研发的JD-1紫外光固化树脂属于有机合成材料
答案:
D
9. 纳米级$Cu_{2}O$因具有优良的催化性能备受关注。某兴趣小组在老师的带领下开展纳米级$Cu_{2}O$的制备研究,其流程如图所示。
(1)在细菌作用下,岩石中的硫化铜(CuS)与空气中的氧气反应生成硫酸铜,反应的化学方程式为
(2)③中观察到的现象是
(3)在加热条件下,用液态肼$(N_{2}H_{4})$还原新制Cu(OH)₂生成Cu₂O、$N_{2}和H_{2}O$,该反应的化学方程式为
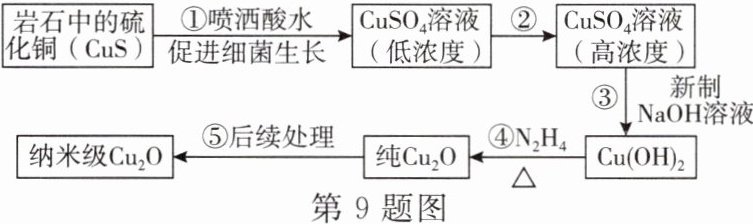
(1)在细菌作用下,岩石中的硫化铜(CuS)与空气中的氧气反应生成硫酸铜,反应的化学方程式为
CuS+2O₂$\stackrel{细菌}{=}$CuSO₄
。(2)③中观察到的现象是
产生蓝色絮状沉淀
。(3)在加热条件下,用液态肼$(N_{2}H_{4})$还原新制Cu(OH)₂生成Cu₂O、$N_{2}和H_{2}O$,该反应的化学方程式为
N₂H₄+4Cu(OH)₂$\stackrel{\triangle}{=}$2Cu₂O+N₂↑+6H₂O
,$Cu_{2}O$中铜元素的化合价是 +1
价。
答案:
(1)CuS+2O₂$\stackrel{细菌}{=}$CuSO₄ (2)产生蓝色絮状沉淀
(3)N₂H₄+4Cu(OH)₂$\stackrel{\triangle}{=}$2Cu₂O+N₂↑+6H₂O +1
(3)N₂H₄+4Cu(OH)₂$\stackrel{\triangle}{=}$2Cu₂O+N₂↑+6H₂O +1
10. 实验室采用还原法制备新型材料纳米级铁粉,其流程如图所示。
(1)纳米级Fe粉在空气中易燃烧,其生成物名称是
(2)实验中通入$N_{2}$的目的是
(3)Ⅱ中发生反应的化学方程式为

(1)纳米级Fe粉在空气中易燃烧,其生成物名称是
四氧化三铁
。(2)实验中通入$N_{2}$的目的是
排尽空气,防止生成的铁粉被氧化
。(3)Ⅱ中发生反应的化学方程式为
H₂+FeCl₂$\stackrel{高温}{=}$Fe+2HCl
。
答案:
(1)四氧化三铁 (2)排尽空气,防止生成的铁粉被氧化
(3)H₂+FeCl₂$\stackrel{高温}{=}$Fe+2HCl
(3)H₂+FeCl₂$\stackrel{高温}{=}$Fe+2HCl
11.[科学探究]碱式碳酸锌用于制备功能材料ZnO,其化学反应表达式为$Zn_{x}(OH)_{y}(CO_{3})_{z}\xrightarrow []{煅烧}ZnO+CO_{2}\uparrow +H_{2}O$(x、y、z为正整数)。小金设计了如图甲所示的装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确)。
(1)图甲中装置B的作用是吸收
(2)查阅资料发现,在不同温度条件下充分加热等质量的碱式碳酸锌样品,剩余固体的质量与加热温度的关系如图乙所示。实验中加热时,热分解装置的温度至少要达到
(3)部分实验步骤为:……“加热前先通入$N_{2}$排尽装置内的空气,关闭通入$N_{2}$的活塞,……控制一定温度下加热……”。实验过程中可根据
(4)小金取54.7g碱式碳酸锌样品(不含杂质),放置于热分解装置内,完全反应后测得装置A增重5.4g,装置B增重8.8g。则x:y:z的最简整数比为
(1)图甲中装置B的作用是吸收
碱式碳酸锌分解产生的二氧化碳
。(2)查阅资料发现,在不同温度条件下充分加热等质量的碱式碳酸锌样品,剩余固体的质量与加热温度的关系如图乙所示。实验中加热时,热分解装置的温度至少要达到
300
$^{\circ }C$(选填“200”“300”或“400”)。(3)部分实验步骤为:……“加热前先通入$N_{2}$排尽装置内的空气,关闭通入$N_{2}$的活塞,……控制一定温度下加热……”。实验过程中可根据
装置A中不再产生气泡,装置A、B质量不再增加
的现象判断碱式碳酸锌样品已反应完全。(4)小金取54.7g碱式碳酸锌样品(不含杂质),放置于热分解装置内,完全反应后测得装置A增重5.4g,装置B增重8.8g。则x:y:z的最简整数比为
5∶6∶2
。
答案:
(1)碱式碳酸锌分解产生的二氧化碳 (2)300 (3)装置A中不再产生气泡,装置A、B质量不再增加 (4)5∶6∶2
查看更多完整答案,请扫码查看


