第13页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
5. 小科利用如图甲所示的装置对盐酸和氢氧化钠溶液反应进行探究,测量结果如图乙和图丙所示。下列说法正确的是(
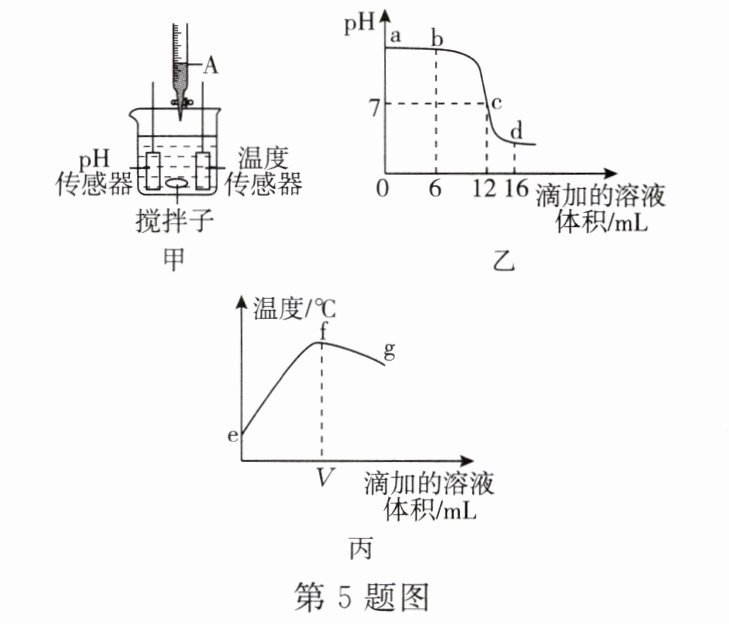
A.图甲中仪器A盛放的是NaOH溶液
B.图乙中a→d所示溶液中NaCl的质量不断增加
C.图丙中V的数值最接近12
D.图丙中从f→g温度变化趋势可说明该反应是吸热反应
C
)
A.图甲中仪器A盛放的是NaOH溶液
B.图乙中a→d所示溶液中NaCl的质量不断增加
C.图丙中V的数值最接近12
D.图丙中从f→g温度变化趋势可说明该反应是吸热反应
答案:
5.C
6. 某校科学小组在利用盐酸和氢氧化钾溶液探究酸碱中和反应时,将一溶液逐滴滴加到盛有另一种溶液的烧杯中,利用数字化传感器得到烧杯中溶液pH的变化图像(如图所示)。
(1)根据图像分析可知实验前烧杯中溶液为
(2)向图中c点所示溶液中加入一定量的碳酸钠溶液,反应后所得溶液中一定含有的溶质是

(1)根据图像分析可知实验前烧杯中溶液为
氢氧化钾溶液
。(2)向图中c点所示溶液中加入一定量的碳酸钠溶液,反应后所得溶液中一定含有的溶质是
${KCl}$、${NaCl}$
(填化学式)。
答案:
6.(1)氢氧化钾溶液 (2)${KCl}$、${NaCl}$
7. 某兴趣小组同学向氢氧化钠溶液中滴加稀盐酸时,未观察到明显现象,为了探究二者是否发生反应,同学们设计了如下实验:
【实验一】取一只烧杯,内装有滴有无色酚酞试液的氢氧化钠溶液,将稀盐酸慢慢滴入该烧杯中,并不断搅拌,溶液的颜色变化是
【实验二】向反应后的溶液中加入氯化铜溶液,观察到
【实验一】取一只烧杯,内装有滴有无色酚酞试液的氢氧化钠溶液,将稀盐酸慢慢滴入该烧杯中,并不断搅拌,溶液的颜色变化是
红色逐渐褪去
,证明盐酸与氢氧化钠发生了反应。【实验二】向反应后的溶液中加入氯化铜溶液,观察到
无蓝色沉淀产生
,证明氢氧化钠已被反应完全,写出氢氧化钠与稀盐酸反应的化学方程式:NaOH + HCl = NaCl + H2O
。这是从反应物消失的角度来证明稀盐酸和氢氧化钠发生了反应。
答案:
7.【实验一】红色逐渐褪去 【实验二】无蓝色沉淀产生 ${NaOH + HCl = NaCl + H2O}$
8. 某科学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀$H_2SO_4$加入盛有NaOH溶液的小烧杯中。
【反应原理】(1)该反应的化学方程式:
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中的溶质是什么呢?
【假设猜想】(2)针对疑问,大家纷纷提出猜想:
猜想一:只有$Na_2SO_4;$
猜想二:有$Na_2SO_4$和$H_2SO_4;$
猜想三:
【实验探究】(3)①甲组同学取少量烧杯中的溶液于试管中,滴加几滴$FeCl_3$溶液,无明显变化,溶液中一定没有
②为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、$BaCl_2$溶液、$Na_2CO_3$溶液,进行如表所示的三个方案的探究:

【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】(4)老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验探究】②中存在两处明显错误,请大家反思。同学们经过反思发现了以下两处错误:
Ⅰ. 实验操作中的错误是
Ⅱ. 实验方案中也有一个是错误的,错误的原因是
【演示实验】将一定量的稀$H_2SO_4$加入盛有NaOH溶液的小烧杯中。
【反应原理】(1)该反应的化学方程式:
${H2SO4 + 2NaOH = Na2SO4 + 2H2O}$
。【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中的溶质是什么呢?
【假设猜想】(2)针对疑问,大家纷纷提出猜想:
猜想一:只有$Na_2SO_4;$
猜想二:有$Na_2SO_4$和$H_2SO_4;$
猜想三:
有${Na2SO4}$和${NaOH}$
。【实验探究】(3)①甲组同学取少量烧杯中的溶液于试管中,滴加几滴$FeCl_3$溶液,无明显变化,溶液中一定没有
${NaOH}$(或氢氧化钠)
。②为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、$BaCl_2$溶液、$Na_2CO_3$溶液,进行如表所示的三个方案的探究:

【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】(4)老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验探究】②中存在两处明显错误,请大家反思。同学们经过反思发现了以下两处错误:
Ⅰ. 实验操作中的错误是
将pH试纸浸入溶液中
。Ⅱ. 实验方案中也有一个是错误的,错误的原因是
${BaCl2}$和${Na2SO4}$反应也会生成白色沉淀,不能证明溶液中一定有${H2SO4}$存在
。
答案:
8.(1)${H2SO4 + 2NaOH = Na2SO4 + 2H2O}$ (2)有${Na2SO4}$和${NaOH}$ (3)①${NaOH}$(或氢氧化钠) ②有气泡产生(4)Ⅰ.将pH试纸浸入溶液中 Ⅱ.${BaCl2}$和${Na2SO4}$反应也会生成白色沉淀,不能证明溶液中一定有${H2SO4}$存在
查看更多完整答案,请扫码查看


