第12页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
1. 盐酸、硫酸和硝酸都是重要的酸,下列是探究酸性质的实验。

(1)图甲中,一定能区分稀盐酸和稀硫酸的是实验
(2)若实验二中稀硫酸和硝酸钡溶液恰好完全反应,反应的化学方程式为
(3)如图乙所示是装有稀硫酸的试管中加入硝酸钡溶液前后主要离子种类及个数比变化示意图,则“●”代表的离子是
(4)下列物质能证明实验一中稀盐酸有剩余的是
A. CuO
$B. AgNO_3$
$C. CaCl_2$
D. pH试纸

(1)图甲中,一定能区分稀盐酸和稀硫酸的是实验
二
(选填“一”或“二”)。(2)若实验二中稀硫酸和硝酸钡溶液恰好完全反应,反应的化学方程式为
${H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3}$
。(3)如图乙所示是装有稀硫酸的试管中加入硝酸钡溶液前后主要离子种类及个数比变化示意图,则“●”代表的离子是
${H+}$
(填离子符号)。(4)下列物质能证明实验一中稀盐酸有剩余的是
B
(填字母)。A. CuO
$B. AgNO_3$
$C. CaCl_2$
D. pH试纸
答案:
1.(1)二 (2)${H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3}$(3)${H+}$ (4)B
2. 小金在学习“常见的碱”过程中,将新配制的饱和$Ca(OH)_2$溶液滴入到$FeCl_3$溶液中,发现没有出现预期的红褐色沉淀。这是为什么呢?小金查阅资料,获取如下信息:$①Ca(OH)_2$微溶于水;$②FeCl_3$溶液呈酸性。
于是他提出以下猜想:
猜想一:$Ca(OH)_2$没有参加化学反应。
猜想二:滴入的$Ca(OH)_2$溶液中OH⁻数量太少。
猜想三:$FeCl_3$溶液呈酸性$,Fe(OH)_3$沉淀不能存在。

(1)请你用pH试纸帮助小金来排除猜想一,写出你的操作方法:
(2)为增加OH⁻的数量,换用浓NaOH溶液滴加到$FeCl_3$溶液中(如图甲所示),若猜想二正确,则观察到的现象是
(3)经过实验,猜想三验证成立。然后,小金将$FeCl_3$溶液逐滴滴加到饱和$Ca(OH)_2$溶液中(如图乙所示),先观察到红褐色沉淀产生,持续滴加后沉淀又消失了,请你解释沉淀会消失的原因:
于是他提出以下猜想:
猜想一:$Ca(OH)_2$没有参加化学反应。
猜想二:滴入的$Ca(OH)_2$溶液中OH⁻数量太少。
猜想三:$FeCl_3$溶液呈酸性$,Fe(OH)_3$沉淀不能存在。

(1)请你用pH试纸帮助小金来排除猜想一,写出你的操作方法:
在白瓷板或玻璃片上放一小片pH试纸,用洁净的玻璃棒蘸取${Ca(OH)2}$和${FeCl3}$混合液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH,并与未滴加${Ca(OH)2}$的${FeCl3}$溶液pH进行比较
。(2)为增加OH⁻的数量,换用浓NaOH溶液滴加到$FeCl_3$溶液中(如图甲所示),若猜想二正确,则观察到的现象是
产生红褐色沉淀
。(3)经过实验,猜想三验证成立。然后,小金将$FeCl_3$溶液逐滴滴加到饱和$Ca(OH)_2$溶液中(如图乙所示),先观察到红褐色沉淀产生,持续滴加后沉淀又消失了,请你解释沉淀会消失的原因:
${FeCl3}$溶液显酸性,当${FeCl3}$溶液过量时,产生的${Fe(OH)3}$沉淀在酸性溶液中又消失
。
答案:
2.(1)在白瓷板或玻璃片上放一小片pH试纸,用洁净的玻璃棒蘸取${Ca(OH)2}$和${FeCl3}$混合液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH,并与未滴加${Ca(OH)2}$的${FeCl3}$溶液pH进行比较 (2)产生红褐色沉淀(3)${FeCl3}$溶液显酸性,当${FeCl3}$溶液过量时,产生的${Fe(OH)3}$沉淀在酸性溶液中又消失
3. 某科学兴趣小组用数字化传感器探究氢氧化钠稀溶液与稀盐酸反应过程中温度和pH的变化,测定结果如图甲、乙所示。下列说法正确的是(
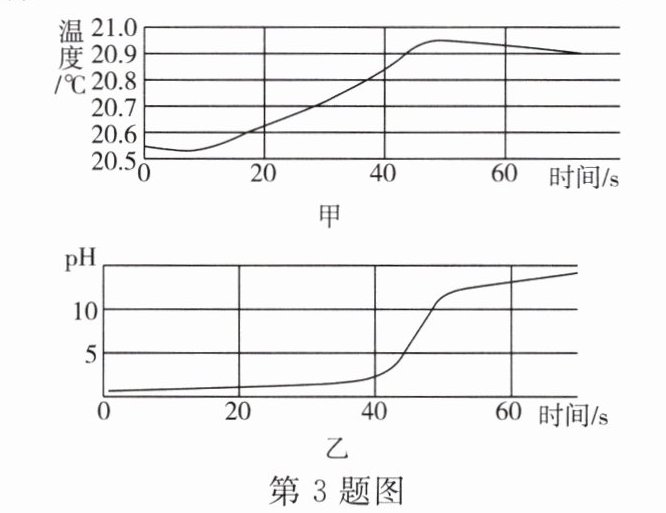
A.该实验是将盐酸溶液滴入氢氧化钠溶液
B.稀盐酸与氢氧化钠溶液反应是吸热反应
C.20s至40s之间的某一时刻,两溶液恰好完全反应
D.60s时溶液中的溶质为NaOH和NaCl
D
)
A.该实验是将盐酸溶液滴入氢氧化钠溶液
B.稀盐酸与氢氧化钠溶液反应是吸热反应
C.20s至40s之间的某一时刻,两溶液恰好完全反应
D.60s时溶液中的溶质为NaOH和NaCl
答案:
3.D
4. 氢氧化钠与稀硫酸反应是否放出热量?三位同学为探究此问题进行了如图所示的实验:
(1)A同学按图甲进行实验:在烧杯中先加入一定量的稀硫酸溶液,然后再加入适量的氢氧化钠固体,观察到温度计示数变大,于是得到“反应放出热量”的结论。请你判断是否正确并说明理由:
(2)B同学按图乙进行实验,可以根据
(3)C同学是将稀硫酸不断滴入氢氧化钠溶液中,并用数字化仪器测量数据(如图丙所示)。由图丙可知,当反应进行到20s时溶液中的溶质是
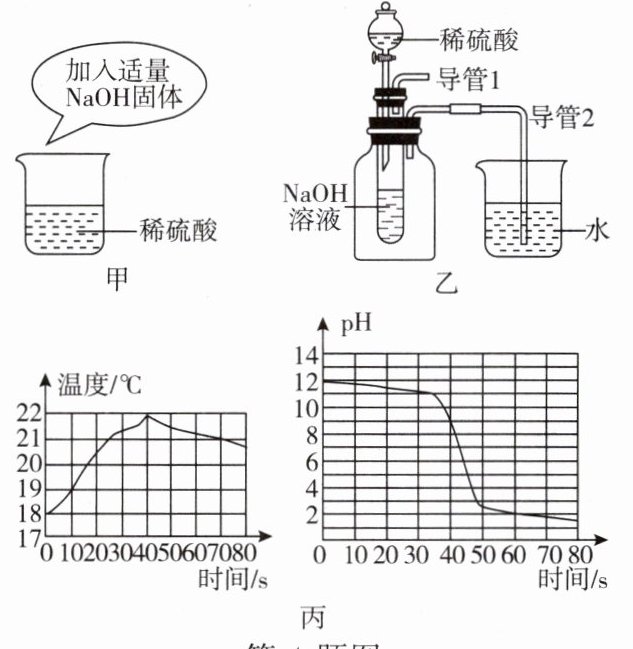
(1)A同学按图甲进行实验:在烧杯中先加入一定量的稀硫酸溶液,然后再加入适量的氢氧化钠固体,观察到温度计示数变大,于是得到“反应放出热量”的结论。请你判断是否正确并说明理由:
不正确,氢氧化钠固体溶于水也放热,会对实验形成干扰
。(2)B同学按图乙进行实验,可以根据
导管2口有气泡
的现象证明该反应放出热量。(3)C同学是将稀硫酸不断滴入氢氧化钠溶液中,并用数字化仪器测量数据(如图丙所示)。由图丙可知,当反应进行到20s时溶液中的溶质是
${NaOH}$和${Na2SO4}$
(填化学式)。
答案:
4.(1)不正确,氢氧化钠固体溶于水也放热,会对实验形成干扰(2)导管2口有气泡 (3)${NaOH}$和${Na2SO4}$
查看更多完整答案,请扫码查看


