第22页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
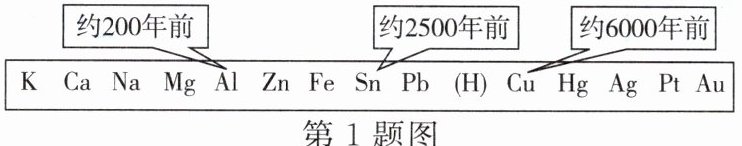
1. 如图所示为金属活动性顺序表中铜、锡和铝被人类大规模冶炼、利用的大致年限。分析该图的规律,你认为金属被大规模冶炼、利用的先后顺序跟下列哪个因素有关(
A.金属的导电性
B.金属的延展性
C.金属的颜色
D.金属的活动性
D
)
A.金属的导电性
B.金属的延展性
C.金属的颜色
D.金属的活动性
答案:
D
2. 把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,关于出现的现象,下列叙述正确的是(
A.溶液从蓝色变浅直至无色
B.铁钉表面析出红色物质
C.产生大量气泡
D.溶液质量增加
B
)A.溶液从蓝色变浅直至无色
B.铁钉表面析出红色物质
C.产生大量气泡
D.溶液质量增加
答案:
B
3. 下列有关金属发生反应的说法中,正确的是(
A.凡是有金属单质生成的反应一定是置换反应
B.金属都能与酸发生置换反应
C.活泼金属都能从不活泼金属的盐中置换出不活泼金属
D.在金属锌表面镀铜利用了铜的活动性比锌弱的特性
D
)A.凡是有金属单质生成的反应一定是置换反应
B.金属都能与酸发生置换反应
C.活泼金属都能从不活泼金属的盐中置换出不活泼金属
D.在金属锌表面镀铜利用了铜的活动性比锌弱的特性
答案:
D
4. 下列现象和事实,可用金属活动性顺序作出合理解释的是(
①金属镁在空气中比铝更易点燃,说明镁比铝活动性强
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强
③用硫酸铜、石灰乳配制农药波尔多液时,不宜用铁制容器
④金属锌与稀硫酸反应速率适中,更适于实验室制取氢气
A.①②
B.③④
C.①③④
D.①②③④
C
)①金属镁在空气中比铝更易点燃,说明镁比铝活动性强
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强
③用硫酸铜、石灰乳配制农药波尔多液时,不宜用铁制容器
④金属锌与稀硫酸反应速率适中,更适于实验室制取氢气
A.①②
B.③④
C.①③④
D.①②③④
答案:
C
5. 一种以黄铜渣(含Zn、Cu、ZnO、CuO)为原料获取Cu和$ZnSO_4$溶液的实验流程如图所示,下列说法正确的是(

A.加入$H_2SO_4$生成$H_2$的化学方程式为$Cu + H_2SO_4 = CuSO_4 + H_2↑$
B.根据流程可判断Zn的金属活动性比Cu强
C.判断加入的Zn已过量的依据是溶液中有固体剩余
D.流程中涉及的化学反应类型均为置换反应
B
)
A.加入$H_2SO_4$生成$H_2$的化学方程式为$Cu + H_2SO_4 = CuSO_4 + H_2↑$
B.根据流程可判断Zn的金属活动性比Cu强
C.判断加入的Zn已过量的依据是溶液中有固体剩余
D.流程中涉及的化学反应类型均为置换反应
答案:
B
6. 小敏阅读教材得知:将铜片和锌片同时插入稀$H_2SO_4,$可以组成一个电池(图甲)。那么该电池的正负极与什么有关呢?对此,小敏做了三组实验,并借助灵敏电流表进行判断(图乙)。发现该电池的正负极与金属活动性强弱有关且存在一定规律。据此判断,下列金属片组合可以使电流表指针向左偏转(图丙)的是(

A.a铝片、b镁片
B.a铁片、b锌片
C.a铁片、b铜片
D.a铜片、b银片
C
)
A.a铝片、b镁片
B.a铁片、b锌片
C.a铁片、b铜片
D.a铜片、b银片
答案:
C
7. 如图所示,将金属X插入烧杯内的$AgNO_3$溶液中,观察到溶液颜色变蓝后立即取出X,向烧杯内再加入一定量锌粉,振荡后,溶液蓝色逐渐消失。

(1)金属X是
(2)加入金属X后,溶液变蓝色的原因是
(3)实验结束后,烧杯内的溶液中一定

(1)金属X是
Cu(或铜)
。(2)加入金属X后,溶液变蓝色的原因是
Cu+2AgNO₃=Cu(NO₃)₂+2Ag
(用化学方程式表示)。(3)实验结束后,烧杯内的溶液中一定
不存在
(选填“存在”或“不存在$”)AgNO_3,$一定存在Zn(NO₃)₂
(填化学式)。写出加入锌粉发生反应的化学方程式:Zn+2AgNO₃=Zn(NO₃)₂+2Ag;Zn+Cu(NO₃)₂=Zn(NO₃)₂+Cu
。
答案:
(1)Cu(或铜)
(2)Cu+2AgNO₃=Cu(NO₃)₂+2Ag
(3)不存在 Zn(NO₃)₂ Zn+2AgNO₃=Zn(NO₃)₂+2Ag;Zn+Cu(NO₃)₂=Zn(NO₃)₂+Cu
(1)Cu(或铜)
(2)Cu+2AgNO₃=Cu(NO₃)₂+2Ag
(3)不存在 Zn(NO₃)₂ Zn+2AgNO₃=Zn(NO₃)₂+2Ag;Zn+Cu(NO₃)₂=Zn(NO₃)₂+Cu
8. 钴(Co)的金属活动性与铁相似,钴的化合物相关性质如表所示。下列预测合理的是(

A.Co能从$MgCl_2$溶液中置换出Mg
B.CoO能与盐酸反应得到粉红色溶液
C.CoCO_3$能与盐酸反应生成$H_2
$D.Co(OH)_2$可由Co与NaOH溶液反应制得
B
)
A.Co能从$MgCl_2$溶液中置换出Mg
B.CoO能与盐酸反应得到粉红色溶液
C.CoCO_3$能与盐酸反应生成$H_2
$D.Co(OH)_2$可由Co与NaOH溶液反应制得
答案:
B
查看更多完整答案,请扫码查看


