第27页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
12. 氢能是一种极具发展潜力的清洁能源。以太阳能为热源,用硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示:
(1) 写出反应Ⅰ中,发生反应的化学方程式:
(2) 整个反应过程中,$ SO_2 $、$ H_2SO_4 $、$ I_2 $、HI都在循环使用,高效、无污染。在反应Ⅲ中,反应前后化合价发生改变的元素是

(1) 写出反应Ⅰ中,发生反应的化学方程式:
2H₂O+I₂+SO₂=2HI+H₂SO₄
。(2) 整个反应过程中,$ SO_2 $、$ H_2SO_4 $、$ I_2 $、HI都在循环使用,高效、无污染。在反应Ⅲ中,反应前后化合价发生改变的元素是
H、I
。
答案:
(1)2H₂O+I₂+SO₂=2HI+H₂SO₄
(2)H、I
(1)2H₂O+I₂+SO₂=2HI+H₂SO₄
(2)H、I
13. 如图所示为铜片A的系列变化,回答下列问题:
(1) 若方法1中的X物质为工业常用气体,且不发生置换反应,则X是
(2) 写出方法2的化学方程式:
(3) 铜片A、铜片B、铜片C的质量分别为$ m_A $、$ m_B $、$ m_C $,其中方法1和方法2均完全反应,则$ m_A $、$ m_B $、$ m_C $的大小关系为
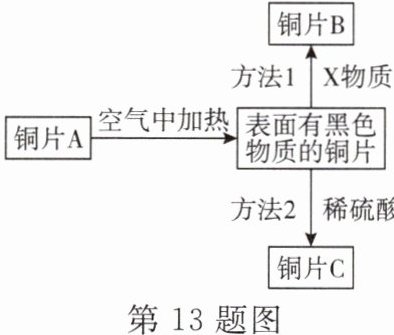
(1) 若方法1中的X物质为工业常用气体,且不发生置换反应,则X是
CO
(填化学式)。(2) 写出方法2的化学方程式:
CuO+H₂SO₄=CuSO₄+H₂O
。(3) 铜片A、铜片B、铜片C的质量分别为$ m_A $、$ m_B $、$ m_C $,其中方法1和方法2均完全反应,则$ m_A $、$ m_B $、$ m_C $的大小关系为
mₐ=mᵦ>mᶜ
。
答案:
(1)CO
(2)CuO+H₂SO₄=CuSO₄+H₂O
(3)mₐ=mᵦ>mᶜ
(1)CO
(2)CuO+H₂SO₄=CuSO₄+H₂O
(3)mₐ=mᵦ>mᶜ
14. 某研究性学习小组对“$ SO_2 能否与 H_2O $反应生成酸”进行探究。请你参与他们的探究活动,并回答下列有关问题。
【查阅资料】①$ SO_2 $常温下是一种无色气体,易溶于水;②酸能使蓝色石蕊试纸变成红色;③$ SO_2 $有毒。
【提出假设】$ SO_2 能与 H_2O $反应生成酸。
【实验探究】设计如图所示的装置进行实验。
(1) 实验过程中,装置A内蓝色石蕊试纸的颜色始终没有变化,装置A的作用是
(2) 在通入$ SO_2 $之前将装置B中胶头滴管内的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,此操作的目的是
【结论】原假设成立。
【反思与评价】该实验方案中,有一个明显的疏漏,请你帮他们指出:
【拓展探究】该研究性学习小组取硫酸厂(生产过程中产生$ SO_2 $)附近刚降落的雨水进行测定,每隔5min测一次pH,其数据如表所示:

分析上述数据的变化,你能得出的结论是
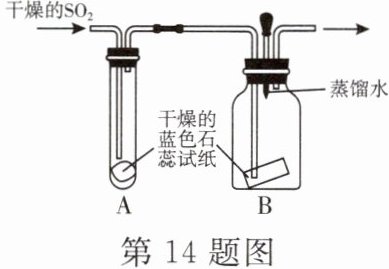
【查阅资料】①$ SO_2 $常温下是一种无色气体,易溶于水;②酸能使蓝色石蕊试纸变成红色;③$ SO_2 $有毒。
【提出假设】$ SO_2 能与 H_2O $反应生成酸。
【实验探究】设计如图所示的装置进行实验。
(1) 实验过程中,装置A内蓝色石蕊试纸的颜色始终没有变化,装置A的作用是
证明SO₂不能使蓝色石蕊试纸变色
。(2) 在通入$ SO_2 $之前将装置B中胶头滴管内的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,此操作的目的是
证明水不能使蓝色石蕊试纸变色
。当有$ SO_2 $通过时发现湿润的蓝色石蕊试纸变红,此现象说明SO₂与水反应生成了酸
,此过程中反应的化学方程式为SO₂+H₂O=H₂SO₃
。【结论】原假设成立。
【反思与评价】该实验方案中,有一个明显的疏漏,请你帮他们指出:
没有尾气处理装置
。【拓展探究】该研究性学习小组取硫酸厂(生产过程中产生$ SO_2 $)附近刚降落的雨水进行测定,每隔5min测一次pH,其数据如表所示:

分析上述数据的变化,你能得出的结论是
随着时间的变化,雨水的酸性逐渐增强
。
答案:
【实验探究】
(1)证明SO₂不能使蓝色石蕊试纸变色
(2)证明水不能使蓝色石蕊试纸变色 SO₂与水反应生成了酸 SO₂+H₂O=H₂SO₃ 【反思与评价】没有尾气处理装置 【拓展探究】随着时间的变化,雨水的酸性逐渐增强
(1)证明SO₂不能使蓝色石蕊试纸变色
(2)证明水不能使蓝色石蕊试纸变色 SO₂与水反应生成了酸 SO₂+H₂O=H₂SO₃ 【反思与评价】没有尾气处理装置 【拓展探究】随着时间的变化,雨水的酸性逐渐增强
15. [科学探究]课外,小科和老师继续探究铁粉和硫粉反应的实验:他们各自取一定量的铁粉和硫粉均匀混合后放在石棉网上,在其中插入烧红的玻璃棒,反应立即发生,拿掉玻璃棒后,反应继续剧烈进行,反应过程中有少量具有刺激性气味的气体X产生,反应结束后,都得到黑色固体。老师得到的黑色固体不会被磁铁吸引,而小科的却会被磁铁吸引。
(1) 铁和硫的反应是
(2) 气体X的化学式为
(3) 对比老师的实验结果,小科猜想自己得到的黑色固体可能是含有剩余的铁或生成了四氧化三铁,小科想验证是否有铁剩余。老师启发小科:硫化亚铁能与稀硫酸反应,产生硫化氢气体,该气体能被氢氧化钠溶液吸收。于是,小科认为正确连接如图所示的三个装置并进行实验,如果装置的导管口a处有水压出,就能验证有铁剩余。
① 小科依次连接:$ e \to $
② 老师指出设计不够合理,不能就此验证猜想。请你说出不够合理的原因:

(1) 铁和硫的反应是
放热
(选填“放热”或“吸热”)反应。(2) 气体X的化学式为
SO₂
。(3) 对比老师的实验结果,小科猜想自己得到的黑色固体可能是含有剩余的铁或生成了四氧化三铁,小科想验证是否有铁剩余。老师启发小科:硫化亚铁能与稀硫酸反应,产生硫化氢气体,该气体能被氢氧化钠溶液吸收。于是,小科认为正确连接如图所示的三个装置并进行实验,如果装置的导管口a处有水压出,就能验证有铁剩余。
① 小科依次连接:$ e \to $
c→d
(选填“$ c \to d $”或“$ d \to c $”)→$ b \to a $。② 老师指出设计不够合理,不能就此验证猜想。请你说出不够合理的原因:
反应前锥形瓶中有空气存在,加入稀硫酸时,锥形瓶中的一部分空气会被排出,即没有氢气产生,a处也会有水压出
。
答案:
(1)放热
(2)SO₂
(3)①c→d ②反应前锥形瓶中有空气存在,加入稀硫酸时,锥形瓶中的一部分空气会被排出,即没有氢气产生,a处也会有水压出
(1)放热
(2)SO₂
(3)①c→d ②反应前锥形瓶中有空气存在,加入稀硫酸时,锥形瓶中的一部分空气会被排出,即没有氢气产生,a处也会有水压出
查看更多完整答案,请扫码查看


