第52页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
11. 下列各组物质中,按酸、碱、盐顺序排列的是 ( )
A. $KNO_{3}$、$NaOH$、$HCl$
B. $Ca(OH)_{2}$、$HCl$、$NaCl$
C. $H_{2}SO_{4}$、$Na_{2}CO_{3}$、$Ba(OH)_{2}$
D. $HNO_{3}$、$KOH$、$CuSO_{4}$
A. $KNO_{3}$、$NaOH$、$HCl$
B. $Ca(OH)_{2}$、$HCl$、$NaCl$
C. $H_{2}SO_{4}$、$Na_{2}CO_{3}$、$Ba(OH)_{2}$
D. $HNO_{3}$、$KOH$、$CuSO_{4}$
答案:
D
12. 氯化钠溶液中溶有少量碳酸钠,下列物质中可用来除去碳酸钠的是 ( )
A. 锌粉
B. 氢氧化钙溶液
C. 盐酸
D. 硫酸
A. 锌粉
B. 氢氧化钙溶液
C. 盐酸
D. 硫酸
答案:
C [解析]A.锌与氯化钠和碳酸钠溶液都不反应,故选项错误;
B.碳酸钠与氢氧化钙溶液反应,生成碳酸钙白色沉淀和氢氧化钠溶液,氢氧化钠是新杂质,故选项错误;C.碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,符合除杂的原则,故选项正确;D.碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,硫酸钠是新杂质,故选项错误。
B.碳酸钠与氢氧化钙溶液反应,生成碳酸钙白色沉淀和氢氧化钠溶液,氢氧化钠是新杂质,故选项错误;C.碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,符合除杂的原则,故选项正确;D.碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,硫酸钠是新杂质,故选项错误。
13. 10g不纯的碳酸钙与足量的盐酸反应生成二氧化碳4.6g,则该不纯物含有的杂质是 ( )
A. $Na_{2}CO_{3}$
B. $K_{2}CO_{3}$
C. $MgCO_{3}$
D. $BaCO_{3}$
A. $Na_{2}CO_{3}$
B. $K_{2}CO_{3}$
C. $MgCO_{3}$
D. $BaCO_{3}$
答案:
C [解析]由下列碳酸盐与盐酸反应放出二氧化碳的关系式可知:
$CaCO_{3}\sim CO_{2}$ $Na_{2}CO_{3}\sim CO_{2}$ $K_{2}CO_{3}\sim CO_{2}$
100 44 106 44 138 44
$MgCO_{3}\sim CO_{2}$ $BaCO_{3}\sim CO_{2}$
84 44 197 44
等质量的碳酸钙、碳酸钠、碳酸钾、碳酸镁、碳酸钡与足量盐酸反应放出二氧化碳的质量由大到小的关系为$MgCO_{3}>CaCO_{3}>Na_{2}CO_{3}>K_{2}CO_{3}>BaCO_{3}$;假设10g样品全部为碳酸钙,根据反应的关系式可确定完全反应后产生二氧化碳的质量为4.4g;而实际产生二氧化碳的质量为4.6g,说明不纯的碳酸钙中含有的杂质是与盐酸反应放出二氧化碳的质量大于碳酸钙的碳酸盐,则含有的杂质是$MgCO_{3}$。
$CaCO_{3}\sim CO_{2}$ $Na_{2}CO_{3}\sim CO_{2}$ $K_{2}CO_{3}\sim CO_{2}$
100 44 106 44 138 44
$MgCO_{3}\sim CO_{2}$ $BaCO_{3}\sim CO_{2}$
84 44 197 44
等质量的碳酸钙、碳酸钠、碳酸钾、碳酸镁、碳酸钡与足量盐酸反应放出二氧化碳的质量由大到小的关系为$MgCO_{3}>CaCO_{3}>Na_{2}CO_{3}>K_{2}CO_{3}>BaCO_{3}$;假设10g样品全部为碳酸钙,根据反应的关系式可确定完全反应后产生二氧化碳的质量为4.4g;而实际产生二氧化碳的质量为4.6g,说明不纯的碳酸钙中含有的杂质是与盐酸反应放出二氧化碳的质量大于碳酸钙的碳酸盐,则含有的杂质是$MgCO_{3}$。
14. 实验室有三瓶失去标签的无色溶液,只知道它们分别是稀盐酸、碳酸钠溶液和澄清石灰水中的一种。为了鉴别它们,将其任意编号为A、B、C,然后两两混合进行实验,实验结果如下表所示:(“↑”表示有气体产生,“↓”表示有沉淀产生,“——”表示无明显现象)
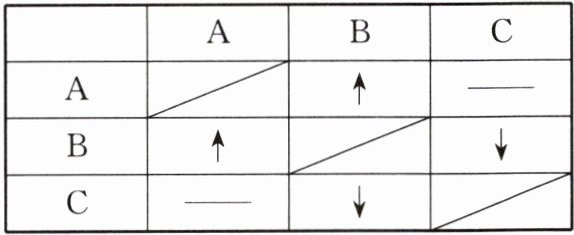
(1)C中溶质的化学式是__________。
(2)A与B反应的化学方程式是____________________。
(3)B与C反应的化学方程式是____________________。
(4)向盛有C的试管中滴入几滴酚酞溶液,然后滴加足量的A,若____________________,则可判断A与C发生了反应。

(1)C中溶质的化学式是__________。
(2)A与B反应的化学方程式是____________________。
(3)B与C反应的化学方程式是____________________。
(4)向盛有C的试管中滴入几滴酚酞溶液,然后滴加足量的A,若____________________,则可判断A与C发生了反应。
答案:
(1)$Ca(OH)_{2}$
(2)$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow$
(3)$Ca(OH)_{2}+Na_{2}CO_{3}=CaCO_{3}\downarrow +2NaOH$
(4)溶液由红色变成无色
(1)$Ca(OH)_{2}$
(2)$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow$
(3)$Ca(OH)_{2}+Na_{2}CO_{3}=CaCO_{3}\downarrow +2NaOH$
(4)溶液由红色变成无色
15. 实操情境家庭生活中制作食品经常用到碳酸钠(苏打)和碳酸氢钠(小苏打),碳酸氢钠不稳定,在潮湿的空气中缓慢分解,受热至65℃以上迅速分解,270℃时完全分解为碳酸钠。某同学为探究它们的性质差异,设计了如图所示装置进行实验。请回答下列问题:
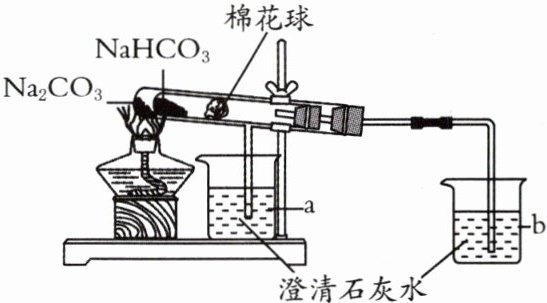
(1)加热一段时间后,a、b两烧杯中分别观察到的现象是____________________,由此可得出的结论是____________________。
(2)碳酸氢钠分解的化学方程式为____________________。
(3)该装置设计的优点是____________________。

(1)加热一段时间后,a、b两烧杯中分别观察到的现象是____________________,由此可得出的结论是____________________。
(2)碳酸氢钠分解的化学方程式为____________________。
(3)该装置设计的优点是____________________。
答案:
(1)a中澄清石灰水不变浑浊,b中澄清石灰水变浑浊
受热时碳酸氢钠易分解,碳酸钠不易分解
(2)$2NaHCO_{3}\xlongequal{\triangle}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow$
(3)可对比两种物质是否能分解
(1)a中澄清石灰水不变浑浊,b中澄清石灰水变浑浊
受热时碳酸氢钠易分解,碳酸钠不易分解
(2)$2NaHCO_{3}\xlongequal{\triangle}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow$
(3)可对比两种物质是否能分解
16.(2022河南)下图是某胃药标签的部分文字说明。碳酸氢钠与胃酸(含盐酸)作用的化学方程式为____________________;如果将该胃药中的碳酸氢钠用相同质量的碳酸镁代替,则每次用药量应__________(填“增加”“减少”或“不变”)。


答案:
$NaHCO_{3}+HCl=NaCl+H_{2}O+CO_{2}\uparrow$ 减少
查看更多完整答案,请扫码查看


