第30页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
5. (岳阳中考)已知A、B、C三种物质的溶解度随温度的变化情况如图所示,现将ag A、bg B、cg C分别在10℃、20℃、30℃时加入100g水中,下列分析正确的是 ( )

A. a、b、c三点表示的溶液均为饱和溶液
B. 三种溶液中溶质质量分数最大的是A
C. c点恰好形成无色、均一、稳定的溶液
D. 升温至30℃时,三种溶液的溶质质量分数关系为:A=C>B

A. a、b、c三点表示的溶液均为饱和溶液
B. 三种溶液中溶质质量分数最大的是A
C. c点恰好形成无色、均一、稳定的溶液
D. 升温至30℃时,三种溶液的溶质质量分数关系为:A=C>B
答案:
D [解析]A. 溶解度曲线上的点表示恰好是饱和的溶液,溶解度曲线上方的点表示饱和溶液且有未溶解的溶质,溶解度曲线下方的点表示不饱和溶液,故 $a$、$c$点表示饱和溶液,$b$点表示不饱和溶液,选项错误;B. 由图像可知 $b<a = c$,$10^{\circ}C$时 $ag$ A 不能全部溶于 100g 水中,$30^{\circ}C$时 $cg$ C 恰好溶于 100g 水中,$20^{\circ}C$时 $bg$ B 完全溶解在 100g 水中,故三种溶液中溶质质量分数最大的是 C,选项错误;C. $c$点形成的恰好是饱和的溶液,溶液是均一、稳定的混合物,但不一定是无色的,与是否饱和无关,选项错误;D. 升温至 $30^{\circ}C$时,A 的溶解度大于 $ag$,$ag$ A 能够完全溶解在 100g 水中,C 的溶解度等于 $cg$,$cg$ C 能完全溶解在 100g 水中,B 的溶解度大于 $bg$,$bg$ B 也能完全溶解在 100g 水中。等量的溶剂中,溶质越多溶质质量分数越大,由图像可知 $a = c>b$,故升温至 $30^{\circ}C$时,三种溶液的溶质质量分数关系为 $A = C>B$,选项正确。
6. (怀化中考)某化学兴趣小组的同学为测定假黄金(铜锌合金)中锌的质量,取20g假黄金置于烧杯中,取120g稀盐酸,分6次加入,充分反应,实验数据如下:
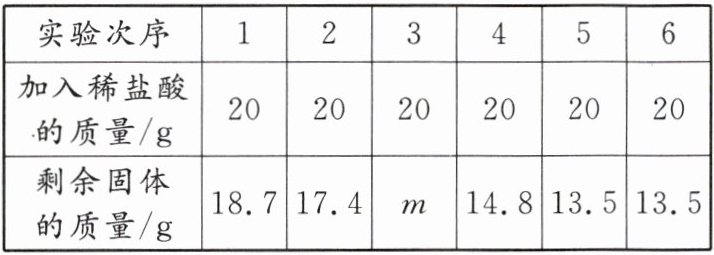
请回答:
(1)表中m=____。
(2)假黄金(铜锌合金)中锌的质量是____g。
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)

请回答:
(1)表中m=____。
(2)假黄金(铜锌合金)中锌的质量是____g。
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
答案:
(1)16.1
(2)6.5
(3)解:设所用稀盐酸中溶质的质量分数是 $x$。
$Zn + 2HCl = ZnCl_2 + H_2\uparrow$
65 73
1.3g $20g\times x$
$\frac{65}{73}=\frac{1.3g}{20g\times x}$ $x = 7.3\%$
答:所用稀盐酸中溶质的质量分数是 7.3%。
(1)16.1
(2)6.5
(3)解:设所用稀盐酸中溶质的质量分数是 $x$。
$Zn + 2HCl = ZnCl_2 + H_2\uparrow$
65 73
1.3g $20g\times x$
$\frac{65}{73}=\frac{1.3g}{20g\times x}$ $x = 7.3\%$
答:所用稀盐酸中溶质的质量分数是 7.3%。
7. 一定浓度的酒精(C₂H₅OH)的水溶液常用来消毒,现有某种酒精的水溶液,经测定溶液中氢元素的质量分数为12%,则该溶液中酒精的质量分数为 ( )
A. 75%
B. 92%
C. 23%
D. 46%
A. 75%
B. 92%
C. 23%
D. 46%
答案:
D [解析]设溶液中酒精与水的分子个数分别为 $n$、$m$。酒精的相对分子质量:$2\times12 + 6\times1 + 16 = 46$;水的相对分子质量为:$2\times1 + 16 = 18$;则$\frac{6n\times1 + 2m\times1}{46\times n + 18\times m}\times100\% = 12\%$,解得 $m = 3n$;该溶液中酒精的质量分数为$\frac{46n}{46n + 18\times3n}\times100\% = 46\%$。
8. (福建中考)如图为我国古代“布灰种盐”生产海盐的部分场景,其过程为“烧草为灰,布在滩场,然后以海水渍之,俟晒结浮白,扫而复淋”。
(1)“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,化学上称之为____。
(2)经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数约为15%),用于煎炼海盐。
①1000g“上等卤水”蒸干后,可得氯化钠的质量约为____g。
②从燃料利用角度分析,用获得的“上等卤水”而不直接用海水煎炼海盐的原因是____。
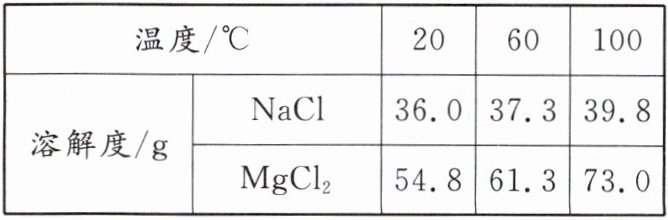
③将“上等卤水”在100℃恒温蒸发至刚有晶体析出,所得溶液的组成为:150g溶液中含水100g、NaCl 39.8g、MgCl₂ 7.65g及其他成分2.55g。将150g此溶液降温至20℃,有____g NaCl析出(溶解度见下表)。此时,____(填“有”或“没有”)MgCl₂析出,原因是____。

(1)“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,化学上称之为____。
(2)经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数约为15%),用于煎炼海盐。
①1000g“上等卤水”蒸干后,可得氯化钠的质量约为____g。
②从燃料利用角度分析,用获得的“上等卤水”而不直接用海水煎炼海盐的原因是____。
③将“上等卤水”在100℃恒温蒸发至刚有晶体析出,所得溶液的组成为:150g溶液中含水100g、NaCl 39.8g、MgCl₂ 7.65g及其他成分2.55g。将150g此溶液降温至20℃,有____g NaCl析出(溶解度见下表)。此时,____(填“有”或“没有”)MgCl₂析出,原因是____。


答案:
(1)蒸发结晶
(2)①150 ②生产等量海盐,后者消耗燃料更多
③3.8 没有 $20^{\circ}C$时溶液中 $MgCl_2$未达到饱和状态
(1)蒸发结晶
(2)①150 ②生产等量海盐,后者消耗燃料更多
③3.8 没有 $20^{\circ}C$时溶液中 $MgCl_2$未达到饱和状态
查看更多完整答案,请扫码查看


