第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
1. (营口中考)下列金属不能与CuCl₂溶液反应的是 ( )
A. Zn
B. Ag
C. Fe
D. Al
A. Zn
B. Ag
C. Fe
D. Al
答案:
B
2. (德阳中考)金俗称“黄金”。德阳市广汉三星堆遗址又发掘出一副黄金面具,向世界再次展现了灿烂的华夏文明,也反映出古蜀人高超的金属冶炼技术和加工水平。以下有关说法正确的是 ( )
A. 黄色、有金属光泽属于金的物理性质
B. 将黄金敲打成面具的过程是化学变化
C. 颜色与黄金高度相似的黄铜富含黄金
D. 金较活泼,黄金面具出土后易被氧化
A. 黄色、有金属光泽属于金的物理性质
B. 将黄金敲打成面具的过程是化学变化
C. 颜色与黄金高度相似的黄铜富含黄金
D. 金较活泼,黄金面具出土后易被氧化
答案:
A
3. (2024临夏州)金属镍在制造钱币、不锈钢、催化剂等方面有着广泛的应用。为探究镍(Ni)、锌、铜的金属活动性顺序,小明做了如图所示的实验,发现A试管中镍丝表面无现象,B试管中镍丝表面出现红色物质,则三种金属活动性由强到弱的顺序是 ( )
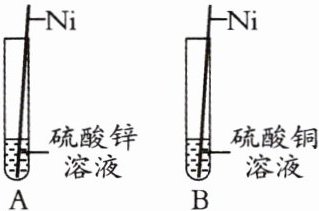
A. Ni、Zn、Cu
B. Zn、Cu、Ni
C. Zn、Ni、Cu
D. Cu、Ni、Zn

A. Ni、Zn、Cu
B. Zn、Cu、Ni
C. Zn、Ni、Cu
D. Cu、Ni、Zn
答案:
C
4. (成都月考)若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不会发生的是 ( )
A. Fe+MnSO₄ = FeSO₄+Mn
B. Mg+MnSO₄ = MgSO₄+Mn
C. Mn+Cu(NO₃)₂ = Mn(NO₃)₂+Cu
D. Mn+2HCl = MnCl₂+H₂↑
A. Fe+MnSO₄ = FeSO₄+Mn
B. Mg+MnSO₄ = MgSO₄+Mn
C. Mn+Cu(NO₃)₂ = Mn(NO₃)₂+Cu
D. Mn+2HCl = MnCl₂+H₂↑
答案:
5. 某兴趣小组在研究Zn - Cu合金、Zn - Fe合金、Fe - Al合金、Fe - Cu合金时,发现其中一种合金6.5g与足量稀盐酸充分反应产生了0.5g气体,该合金可能是 ( )
A. Zn - Cu合金
B. Zn - Fe合金
C. Fe - Al合金
D. Fe - Cu合金
A. Zn - Cu合金
B. Zn - Fe合金
C. Fe - Al合金
D. Fe - Cu合金
答案:
C [解析]铜不能和稀盐酸反应。设6.5g锌与足量的稀盐酸充分反应生成氢气的质量为x。
$Zn + 2HCl = ZnCl_{2} + H_{2}\uparrow$
65 2
6.5g x
$\frac{65}{2}=\frac{6.5g}{x}$ x = 0.2g
设6.5g铁与足量的稀盐酸充分反应生成氢气的质量为y。
$Fe + 2HCl = FeCl_{2} + H_{2}\uparrow$
56 2
6.5g y
$\frac{56}{2}=\frac{6.5g}{y}$ y≈0.23g
设6.5g铝与足量的稀盐酸充分反应生成氢气的质量为z。
$2Al + 6HCl = 2AlCl_{3} + 3H_{2}\uparrow$
54 6
6.5g z
$\frac{54}{6}=\frac{6.5g}{z}$ z≈0.72g
由以上计算可知,6.5gFe - Al合金与足量的稀盐酸充分反应,产生氢气的质量大于0.23g小于0.72g,其中包含0.5g,故选C。
$Zn + 2HCl = ZnCl_{2} + H_{2}\uparrow$
65 2
6.5g x
$\frac{65}{2}=\frac{6.5g}{x}$ x = 0.2g
设6.5g铁与足量的稀盐酸充分反应生成氢气的质量为y。
$Fe + 2HCl = FeCl_{2} + H_{2}\uparrow$
56 2
6.5g y
$\frac{56}{2}=\frac{6.5g}{y}$ y≈0.23g
设6.5g铝与足量的稀盐酸充分反应生成氢气的质量为z。
$2Al + 6HCl = 2AlCl_{3} + 3H_{2}\uparrow$
54 6
6.5g z
$\frac{54}{6}=\frac{6.5g}{z}$ z≈0.72g
由以上计算可知,6.5gFe - Al合金与足量的稀盐酸充分反应,产生氢气的质量大于0.23g小于0.72g,其中包含0.5g,故选C。
6. 如图所示的四个图像,分别对应四种过程,其中正确的是 ( )
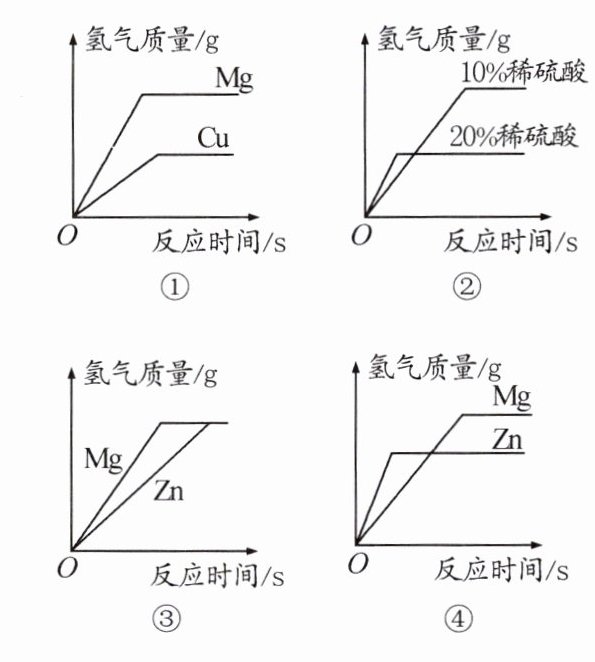
A. ①分别向等质量的Mg和Cu中加入足量等质量、等浓度的稀硫酸
B. ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C. ③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D. ④分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸

A. ①分别向等质量的Mg和Cu中加入足量等质量、等浓度的稀硫酸
B. ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C. ③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D. ④分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸
答案:
C [解析]①Cu不与稀硫酸反应生成氢气,错误;②足量的Zn 与20%的硫酸反应生成氢气多,错误;③Mg比Zn活泼,加入等质量、等浓度的稀硫酸,Mg产生氢气快,最后氢气质量相等,正确;④Mg比Zn活泼、Mg与稀硫酸反应速率快,错误。故选C。
7. 如何用化学方法除去下列物质中的杂质(括号中为杂质),写出有关的化学反应方程式:
(1)Cu(Fe):______________________________。
(2)FeSO₄溶液(CuSO₄):______________________________。
(1)Cu(Fe):______________________________。
(2)FeSO₄溶液(CuSO₄):______________________________。
答案:
(1)$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$(合理即可)
(2)$Fe + CuSO_{4} = FeSO_{4} + Cu$
(1)$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$(合理即可)
(2)$Fe + CuSO_{4} = FeSO_{4} + Cu$
查看更多完整答案,请扫码查看


