第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
1. (北京二模)下列物质中,不属于合金的是 ( )
A. 黄铜
B. 不锈钢
C. 陶瓷
D. 生铁
A. 黄铜
B. 不锈钢
C. 陶瓷
D. 生铁
答案:
1.C
2. 下列实验现象描述错误的是 ( )
A. 铁丝在空气中燃烧火星四射
B. 镁在空气中燃烧发出耀眼的白光
C. 铜在空气中加热表面变黑
D. 金在氧气中加热没有明显的现象
A. 铁丝在空气中燃烧火星四射
B. 镁在空气中燃烧发出耀眼的白光
C. 铜在空气中加热表面变黑
D. 金在氧气中加热没有明显的现象
答案:
2.A
3. 下列化学方程式书写正确的是 ( )
A. $\mathrm{Cu}+2\mathrm{HCl}\xlongequal{\;\;}\mathrm{CuCl}_{2}+\mathrm{H}_{2}\uparrow$
B. $\mathrm{Zn}+\mathrm{H}_{2}\mathrm{SO}_{4}\xlongequal{\;\;}\mathrm{ZnSO}_{4}+\mathrm{H}_{2}\uparrow$
C. $\mathrm{Al}+2\mathrm{HCl}\xlongequal{\;\;}\mathrm{AlCl}_{2}+\mathrm{H}_{2}\uparrow$
D. $2\mathrm{Fe}+6\mathrm{HCl}\xlongequal{\;\;}2\mathrm{FeCl}_{3}+3\mathrm{H}_{2}\uparrow$
A. $\mathrm{Cu}+2\mathrm{HCl}\xlongequal{\;\;}\mathrm{CuCl}_{2}+\mathrm{H}_{2}\uparrow$
B. $\mathrm{Zn}+\mathrm{H}_{2}\mathrm{SO}_{4}\xlongequal{\;\;}\mathrm{ZnSO}_{4}+\mathrm{H}_{2}\uparrow$
C. $\mathrm{Al}+2\mathrm{HCl}\xlongequal{\;\;}\mathrm{AlCl}_{2}+\mathrm{H}_{2}\uparrow$
D. $2\mathrm{Fe}+6\mathrm{HCl}\xlongequal{\;\;}2\mathrm{FeCl}_{3}+3\mathrm{H}_{2}\uparrow$
答案:
3.B
4. (河南模拟)将一定质量的镁粉、锌粉和铁粉的混合物与足量的稀盐酸反应,生成氢气$0.4\mathrm{g}$,则金属混合物的质量不可能是( )
A. $4.8\mathrm{g}$
B. $7.4\mathrm{g}$
C. $9.2\mathrm{g}$
D. $11.2\mathrm{g}$
A. $4.8\mathrm{g}$
B. $7.4\mathrm{g}$
C. $9.2\mathrm{g}$
D. $11.2\mathrm{g}$
答案:
4.A [解析]设生成0.4g氢气需要镁的质量为x,锌的质量为y。
$Mg + 2HCl = MgCl_{2} + H_{2}\uparrow$
24 2
x 0.4g
$\frac{24}{2}=\frac{x}{0.4g}$ x = 4.8g
$Zn + 2HCl = ZnCl_{2} + H_{2}\uparrow$
65 2
y 0.4g
$\frac{65}{2}=\frac{y}{0.4g}$ y = 13g
因此原混合物的质量大于4.8g小于13g,故此金属混合物的质量不可能是4.8g。
$Mg + 2HCl = MgCl_{2} + H_{2}\uparrow$
24 2
x 0.4g
$\frac{24}{2}=\frac{x}{0.4g}$ x = 4.8g
$Zn + 2HCl = ZnCl_{2} + H_{2}\uparrow$
65 2
y 0.4g
$\frac{65}{2}=\frac{y}{0.4g}$ y = 13g
因此原混合物的质量大于4.8g小于13g,故此金属混合物的质量不可能是4.8g。
5. (郑州模拟)a、b、c分别代表镁、铝、铁三种金属中的一种,它们与酸反应生成氢气的关系图如下,$x$轴表示和酸反应的金属质量,$y$轴表示产生的氢气质量,则下列说法正确的是 ( )
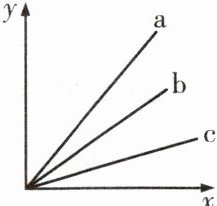
A. 金属活动性顺序是 a>b>c
B. a、b、c分别是铝、镁、铁
C. 生成物中金属元素的化合价是 a>b>c
D. 金属的相对原子质量是 a<b<c

A. 金属活动性顺序是 a>b>c
B. a、b、c分别是铝、镁、铁
C. 生成物中金属元素的化合价是 a>b>c
D. 金属的相对原子质量是 a<b<c
答案:
5.B [解析]根据产生氢气的质量与反应掉的金属的关系图,等质量的金属产生氢气的质量关系是a>b>c,根据一定量金属完全反应产生氢气质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属的质量,设金属质量都为m,则铝、镁、铁与足量酸反应产生氢气的质量分别为$\frac{3}{27}$×m,$\frac{2}{24}$×m,$\frac{2}{56}$×m,因此a为铝、b为镁、c为铁。A.由上述分析可知a、b、c对应的金属分别是铝、镁、铁,根据金属活动性顺序表可知三种金属的活动性由强到弱的顺序为镁、铝、铁,故活动性顺序为b>a>c,故错误;B.由上述分析可知a为铝、b为镁、c 为铁,故正确;C.生成物中铝为+3价,铁为+2价,镁为+2价,故生成物中金属元素的化合价为a>b=c,故错误;D.铝、镁、铁的相对原子质量分别为27、24、56,故金属相对原子质量是b<a<c,故错误。
6. 甲、乙、丙、丁四种金属,只有丙在自然界中主要以单质形式存在,用甲制的容器不能盛放丁盐的水溶液,用乙制的容器却可以盛放丁盐的水溶液。由此推断四种金属的活动性由强到弱的顺序是 ( )
A. 丙>乙>甲>丁
B. 甲>丁>乙>丙
C. 丁>甲>乙>丙
D. 甲>乙>丁>丙
A. 丙>乙>甲>丁
B. 甲>丁>乙>丙
C. 丁>甲>乙>丙
D. 甲>乙>丁>丙
答案:
6.B [解析]只有丙在自然界中主要以单质形式存在,说明丙最不活泼,用甲制的容器不能盛放丁盐的水溶液,说明甲比丁活泼,用乙制的容器却可以盛放丁盐的水溶液,说明丁比乙活泼,因此四种金属的活动性由强到弱的顺序是甲>丁>乙>丙。
7. 向一定量的硝酸铜、硝酸银的混合溶液中加入$5.6\mathrm{g}$铁粉,充分反应后过滤、洗涤、干燥,称得固体$14\mathrm{g}$。向固体中加入稀盐酸,无气泡产生。则下列分析正确的是 ( )
A. 滤液中一定不含有硝酸银
B. 滤液中一定含有硝酸铜
C. 滤出的固体中含有银$7.6\mathrm{g}$
D. 滤出的固体中含有铜$6.4\mathrm{g}$
A. 滤液中一定不含有硝酸银
B. 滤液中一定含有硝酸铜
C. 滤出的固体中含有银$7.6\mathrm{g}$
D. 滤出的固体中含有铜$6.4\mathrm{g}$
答案:
7.A [解析]若5.6g的铁完全与硝酸银反应,设生成银的质量为y。
$Fe + 2AgNO_{3} = Fe(NO_{3})_{2} + 2Ag$
56 216
5.6g y
$\frac{56}{216}=\frac{5.6g}{y}$
y = 21.6g
由于21.6g>14g,说明了铁先将溶液中的硝酸银反应完后又与硝酸铜发生了反应,设与硝酸银反应铁的质量为x,则与硝酸铜反应铁的质量为5.6g - x。
$Fe + 2AgNO_{3} = Fe(NO_{3})_{2} + 2Ag$
56 216
x $\frac{216x}{56}$
$Fe + Cu(NO_{3})_{2} = Fe(NO_{3})_{2} + Cu$
56 64
5.6g - x $\frac{64(5.6g - x)}{56}$
$\frac{216x}{56}+\frac{64(5.6g - x)}{56}=14g$ x = 2.8g
由此可知,生成的银的质量为$\frac{216×2.8g}{56}=10.8g$
生成铜的质量为$\frac{64(5.6g - 2.8g)}{56}=3.2g$
由上述计算可知,硝酸银完全发生了反应,滤液中一定不含有硝酸银,故A正确;通过上述计算,不能确定滤液中是否含有硝酸铜,故B错误;滤出的固体中含有银10.8g,故C错误;滤出的固体中含有铜3.2g,故D错误。
$Fe + 2AgNO_{3} = Fe(NO_{3})_{2} + 2Ag$
56 216
5.6g y
$\frac{56}{216}=\frac{5.6g}{y}$
y = 21.6g
由于21.6g>14g,说明了铁先将溶液中的硝酸银反应完后又与硝酸铜发生了反应,设与硝酸银反应铁的质量为x,则与硝酸铜反应铁的质量为5.6g - x。
$Fe + 2AgNO_{3} = Fe(NO_{3})_{2} + 2Ag$
56 216
x $\frac{216x}{56}$
$Fe + Cu(NO_{3})_{2} = Fe(NO_{3})_{2} + Cu$
56 64
5.6g - x $\frac{64(5.6g - x)}{56}$
$\frac{216x}{56}+\frac{64(5.6g - x)}{56}=14g$ x = 2.8g
由此可知,生成的银的质量为$\frac{216×2.8g}{56}=10.8g$
生成铜的质量为$\frac{64(5.6g - 2.8g)}{56}=3.2g$
由上述计算可知,硝酸银完全发生了反应,滤液中一定不含有硝酸银,故A正确;通过上述计算,不能确定滤液中是否含有硝酸铜,故B错误;滤出的固体中含有银10.8g,故C错误;滤出的固体中含有铜3.2g,故D错误。
8. (合肥一模)如图是某同学探究铁钉生锈条件的实验,则下列说法不正确的是 ( )
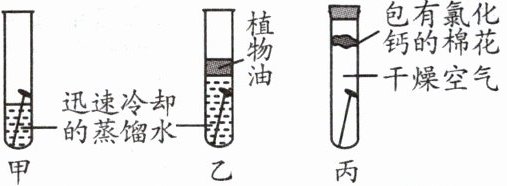
A. 图乙中植物油的作用是隔绝氧气
B. 一周后观察,发现铁钉锈蚀的是甲
C. 丙中氯化钙的目的是除去空气中除氧气以外的其他气体
D. 对比分析三组实验,得出铁生锈需要的条件是氧气和水

A. 图乙中植物油的作用是隔绝氧气
B. 一周后观察,发现铁钉锈蚀的是甲
C. 丙中氯化钙的目的是除去空气中除氧气以外的其他气体
D. 对比分析三组实验,得出铁生锈需要的条件是氧气和水
答案:
8.C
9. 下列说法错误的是 ( )
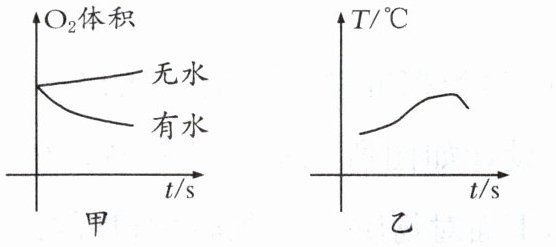
A. 铁钉一般是由铁合金制成的
B. 根据甲图,铁钉生锈过程中$\mathrm{O}_{2}$体积不变
C. 根据甲图,铁钉在潮湿环境更容易生锈
D. 根据乙图,铁钉生锈过程中温度升高

A. 铁钉一般是由铁合金制成的
B. 根据甲图,铁钉生锈过程中$\mathrm{O}_{2}$体积不变
C. 根据甲图,铁钉在潮湿环境更容易生锈
D. 根据乙图,铁钉生锈过程中温度升高
答案:
9.B
查看更多完整答案,请扫码查看


