第48页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
7. (2024信阳模拟)向一定量的稀硫酸中逐滴加入$\mathrm{NaOH}$溶液至过量,测得水的质量、硫酸钠的质量随$\mathrm{NaOH}$溶液质量的变化关系如图所示。下列说法错误的是( )
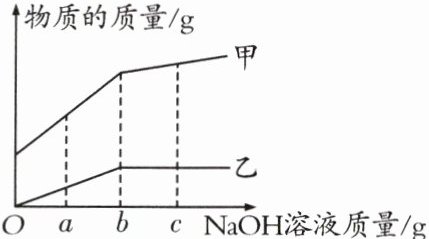
A. 甲表示的物质为水,乙表示的为硫酸钠
B. 加入$b\mathrm{g}\ \mathrm{NaOH}$溶液时,所得溶液恰好为中性
C. 加入$c\mathrm{g}\ \mathrm{NaOH}$溶液时,所得溶液的溶质为硫酸钠
D. $\mathrm{NaOH}$溶液由$a\mathrm{g}$递增到$b\mathrm{g}$,所得溶液的酸性逐渐减弱

A. 甲表示的物质为水,乙表示的为硫酸钠
B. 加入$b\mathrm{g}\ \mathrm{NaOH}$溶液时,所得溶液恰好为中性
C. 加入$c\mathrm{g}\ \mathrm{NaOH}$溶液时,所得溶液的溶质为硫酸钠
D. $\mathrm{NaOH}$溶液由$a\mathrm{g}$递增到$b\mathrm{g}$,所得溶液的酸性逐渐减弱
答案:
C
8. 下列方法可以解决生活中的一些问题:
(1)服用含氢氧化镁的药物可以治疗胃酸过多症,反应的化学方程式为______________________________。
(2)用熟石灰处理硫酸厂污水中含有的硫酸,反应的化学方程式为______________________________。
(3)用稀盐酸除去热水瓶水垢中的碳酸钙,反应的化学方程式为______________________________。
以上三个问题的解决方法中,应用了中和反应原理的是__________(填序号)。
(1)服用含氢氧化镁的药物可以治疗胃酸过多症,反应的化学方程式为______________________________。
(2)用熟石灰处理硫酸厂污水中含有的硫酸,反应的化学方程式为______________________________。
(3)用稀盐酸除去热水瓶水垢中的碳酸钙,反应的化学方程式为______________________________。
以上三个问题的解决方法中,应用了中和反应原理的是__________(填序号)。
答案:
(1)$Mg(OH)_2 + 2HCl \xlongequal{\;\;} MgCl_2 + 2H_2O$
(2)$Ca(OH)_2 + H_2SO_4 \xlongequal{\;\;} CaSO_4 + 2H_2O$
(3)$CaCO_3 + 2HCl \xlongequal{\;\;} CaCl_2 + H_2O + CO_2\uparrow$
(1)
(2)
(1)$Mg(OH)_2 + 2HCl \xlongequal{\;\;} MgCl_2 + 2H_2O$
(2)$Ca(OH)_2 + H_2SO_4 \xlongequal{\;\;} CaSO_4 + 2H_2O$
(3)$CaCO_3 + 2HCl \xlongequal{\;\;} CaCl_2 + H_2O + CO_2\uparrow$
(1)
(2)
9. 跨学科试题化学小组在学习酸和碱的中和反应后,从不同角度开展实验活动,验证氢氧化钠和盐酸能发生反应。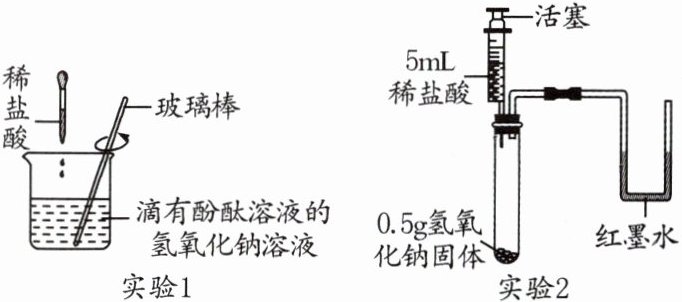
(1)通过溶液酸碱性的变化进行验证。
在实验1中,用滴管缓慢滴入稀盐酸,并不断搅拌。观察到烧杯内溶液由红色变为无色,该现象能证明氢氧化钠与盐酸反应,依据是____________________。用玻璃棒不断搅拌的作用是________________。反应后溶液中一定含有的粒子是____________________(不考虑酚酞)。
(2)利用中和反应放热进行验证。
在实验2中,将稀盐酸全部注入试管中,立即固定活塞。观察到氢氧化钠固体全部消失,U形管的液面左低右高,部分同学由此认为氢氧化钠和盐酸发生了反应。但有的同学不赞同,理由是______________________________(装置气密性良好,稀盐酸挥发忽略不计);他们认为仍利用此装置,再补充一个实验才能达成实验2的目的,实验需要的试剂及用量为____________________。

(1)通过溶液酸碱性的变化进行验证。
在实验1中,用滴管缓慢滴入稀盐酸,并不断搅拌。观察到烧杯内溶液由红色变为无色,该现象能证明氢氧化钠与盐酸反应,依据是____________________。用玻璃棒不断搅拌的作用是________________。反应后溶液中一定含有的粒子是____________________(不考虑酚酞)。
(2)利用中和反应放热进行验证。
在实验2中,将稀盐酸全部注入试管中,立即固定活塞。观察到氢氧化钠固体全部消失,U形管的液面左低右高,部分同学由此认为氢氧化钠和盐酸发生了反应。但有的同学不赞同,理由是______________________________(装置气密性良好,稀盐酸挥发忽略不计);他们认为仍利用此装置,再补充一个实验才能达成实验2的目的,实验需要的试剂及用量为____________________。
答案:
(1)酚酞溶液遇碱性溶液变红色 使反应更充分 $Na^+$、$Cl^-$、$H_2O$
(2)可能是氢氧化钠溶于水造成U形管的液面左低右高 5mL 蒸馏水
(1)酚酞溶液遇碱性溶液变红色 使反应更充分 $Na^+$、$Cl^-$、$H_2O$
(2)可能是氢氧化钠溶于水造成U形管的液面左低右高 5mL 蒸馏水
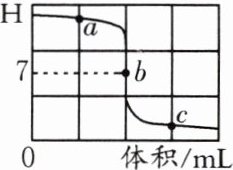
10. (2024河南)某同学用$\mathrm{pH}$传感器测定稀硫酸滴入稀氢氧化钡溶液的过程中$\mathrm{pH}$的变化,测定的结果如图所示。硫酸与氢氧化钡反应的化学方程式为______________________________;$c$点所表示的溶液中溶质为__________;在$a$点所表示的溶液中滴加酚酞溶液,溶液会显______色。(提示:$\mathrm{BaSO_4}$难溶于水)

答案:
$H_2SO_4 + Ba(OH)_2 \xlongequal{\;\;} BaSO_4\downarrow + 2H_2O$ 硫酸 红
查看更多完整答案,请扫码查看


