第32页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
6. (绵阳中考)食盐加碘可有效补充人体碘元素,所加物质一般为KIO₃。NaCl和KIO₃的溶解度如下表:
根据表中数据判断,下列说法错误的是 ( )
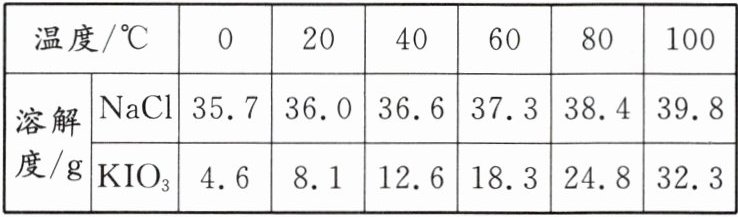
A. 对比数据变化趋势可知,温度对KIO₃溶解度的影响程度更大
B. 在30℃时,NaCl饱和溶液的溶质质量分数大于KIO₃饱和溶液的溶质质量分数
C. 该表转化为溶解度曲线图后,在10~100℃范围内不出现交点
D. 将等质量40℃的两种物质的饱和溶液降温至20℃,NaCl析出晶体质量更大
根据表中数据判断,下列说法错误的是 ( )

A. 对比数据变化趋势可知,温度对KIO₃溶解度的影响程度更大
B. 在30℃时,NaCl饱和溶液的溶质质量分数大于KIO₃饱和溶液的溶质质量分数
C. 该表转化为溶解度曲线图后,在10~100℃范围内不出现交点
D. 将等质量40℃的两种物质的饱和溶液降温至20℃,NaCl析出晶体质量更大
答案:
D [解析]A.由表中数据可知,温度对碘酸钾溶解度的影响程度更大,不符合题意;B.由表中数据可知,20$\degreeCelsius$时,溶解度:氯化钠大于碘酸钾,40$\degreeCelsius$时,溶解度:氯化钠大于碘酸钾,故 30$\degreeCelsius$时,溶解度:氯化钠大于碘酸钾,该温度下,氯化钠饱和溶液的溶质质量分数大于碘酸钾饱和溶液的溶质质量分数,不符合题意;C.由表中数据可知,在 10$\degreeCelsius$~100$\degreeCelsius$范围内,同一温度条件下,氯化钠的溶解度均大于碘酸钾,故该表转化为溶解度曲线图后,在 10$\degreeCelsius$~100$\degreeCelsius$范围内不出现交点,不符合题意;D.将等质量 40$\degreeCelsius$的两种物质的饱和溶液降温至 20$\degreeCelsius$,降温后,两种物质的溶解度均减小,均有溶质析出,但是碘酸钾的溶解度受温度影响更大,故碘酸钾析出的晶体多,符合题意。
7. (2024河南)硝酸钾固体的溶解度曲线如图所示。硝酸钾的溶解度随着温度升高而________(填“增大”或“减小”);20℃时,硝酸钾的饱和溶液中溶质的质量分数为____________________(只写出计算式)。
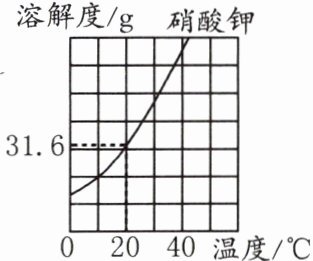

答案:
(1)增大 $\frac{31.6g}{100g + 31.6g}×100\%$
(1)增大 $\frac{31.6g}{100g + 31.6g}×100\%$
8. 溶解是生活中的常见现象,不同物质在水中的溶解能力不同。下列是KNO₃、NaCl在不同温度下的溶解度(单位:g)。
(1)上表中的两种物质在40℃时________的溶解度大。
(2)请写出一种将KNO₃的不饱和溶液转化为饱和溶液的方法:________________________。
(3)20℃时,将20g NaCl放入50g水中,所得溶液的质量是______g。
(4)从NaCl溶液中得到NaCl晶体的方法是__________。

(1)上表中的两种物质在40℃时________的溶解度大。
(2)请写出一种将KNO₃的不饱和溶液转化为饱和溶液的方法:________________________。
(3)20℃时,将20g NaCl放入50g水中,所得溶液的质量是______g。
(4)从NaCl溶液中得到NaCl晶体的方法是__________。
答案:
(1)$KNO_{3}$
(2)降低温度(或加入$KNO_{3}$等)
(3)68
(4)蒸发结晶
(1)$KNO_{3}$
(2)降低温度(或加入$KNO_{3}$等)
(3)68
(4)蒸发结晶
9. (临沂中考)在牙膏中,常用轻质碳酸钙粉末等作摩擦剂。已知某品牌牙膏中的摩擦剂是CaCO₃和SiO₂(SiO₂既不溶于水也不与稀盐酸反应),化学兴趣小组用该牙膏的摩擦剂测定某盐酸中溶质的质量分数,通过实验测得如图数据:(假设产生气体全部逸出)
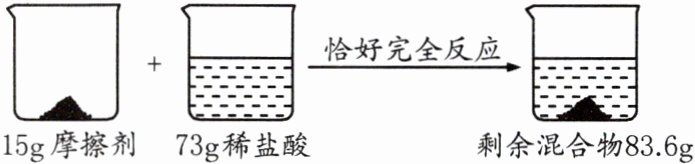
(1)生成CO₂的质量为______g。
(2)求稀盐酸中溶质的质量分数。(写出计算过程)

(1)生成CO₂的质量为______g。
(2)求稀盐酸中溶质的质量分数。(写出计算过程)
答案:
(1)4.4
(2)解:设稀盐酸的溶质质量分数为$x$。
$CaCO_{3}+2HCl = CaCl_{2}+H_{2}O + CO_{2}\uparrow$
73 44
$73g×x$ 4.4g
$\frac{73}{44}=\frac{73g×x}{4.4g}$ $x = 10\%$
答:稀盐酸的溶质质量分数为 10%。
(1)4.4
(2)解:设稀盐酸的溶质质量分数为$x$。
$CaCO_{3}+2HCl = CaCl_{2}+H_{2}O + CO_{2}\uparrow$
73 44
$73g×x$ 4.4g
$\frac{73}{44}=\frac{73g×x}{4.4g}$ $x = 10\%$
答:稀盐酸的溶质质量分数为 10%。
查看更多完整答案,请扫码查看


