第42页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
11. 下列物质能与盐酸反应,但不能生成沉淀或气体的是( )
A. 碳酸钠
B. 铁
C. 氯化钠溶液
D. 氧化铜
A. 碳酸钠
B. 铁
C. 氯化钠溶液
D. 氧化铜
答案:
D [解析]A.碳酸钠能与盐酸反应生成二氧化碳气体,有气体放出,故A错误;B.铁能与盐酸反应生成氢气,有气体产生,故B错误;C.氯化钠不能与盐酸反应,故C错误;D.氧化铜与盐酸反应生成氯化铜和水,无沉淀和气体放出,故D正确。
12. 下列关于盐酸的用途,不能用稀硫酸代替的是( )
A. 与锌反应制取氢气
B. 除去金属表面的锈斑
C. 与大理石反应制取二氧化碳
D. 除去铜粉中混有的少量铁粉
A. 与锌反应制取氢气
B. 除去金属表面的锈斑
C. 与大理石反应制取二氧化碳
D. 除去铜粉中混有的少量铁粉
答案:
C
13. (2024信阳模拟)mg镁铝合金和足量硫酸充分反应,得到0.3g氢气,则m的值可能为( )
A. 2.7
B. 3.2
C. 3.6
D. 3.8
A. 2.7
B. 3.2
C. 3.6
D. 3.8
答案:
B
14. (2024长沙)盐酸(溶质为HCl)是重要的化工产品,盐酸属于__________(填“纯净物”或“混合物”)。盐酸常用于除铁锈,但铁制品不宜在盐酸中长时间浸泡,这是因为盐酸会与铁反应生成氯化亚铁(FeCl₂)和氢气,该反应的化学方程式为__________________________。
答案:
混合物 $2HCl + Fe = FeCl_{2} + H_{2}\uparrow$
15. 取一定量的氧化铜与氧化锌的混合物,加入100g质量分数为19.6%的稀硫酸,恰好完全反应。原固体混合物中氧元素的质量为______g;氧化铜和稀硫酸反应的化学方程式为____________________。
答案:
3.2 $CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$
[解析]原固体混合物中的氧元素和硫酸中的氢元素结合生成水,反应生成水的质量为$100g×19.6\%×\frac{2}{98}÷\frac{2}{18}=3.6g$,则原固体混合物中氧元素的质量为$3.6g×\frac{16}{18}=3.2g$,氧化铜和稀硫酸反应生成硫酸铜和水,反应的化学方程式为$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$。
[解析]原固体混合物中的氧元素和硫酸中的氢元素结合生成水,反应生成水的质量为$100g×19.6\%×\frac{2}{98}÷\frac{2}{18}=3.6g$,则原固体混合物中氧元素的质量为$3.6g×\frac{16}{18}=3.2g$,氧化铜和稀硫酸反应生成硫酸铜和水,反应的化学方程式为$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$。
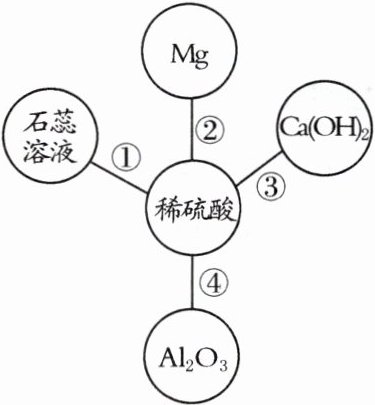
16. 下图是以稀硫酸为例的反应关系,体现了酸的化学性质。结合此图回答下列问题:
(1)稀硫酸中阳离子的符号是______。
(2)反应①中石蕊溶液变为______色。
(3)反应②的化学方程式为______________________________。
(4)反应④的化学方程式为______________________________。
(1)稀硫酸中阳离子的符号是______。
(2)反应①中石蕊溶液变为______色。
(3)反应②的化学方程式为______________________________。
(4)反应④的化学方程式为______________________________。

答案:
(1)$H^{+}$
(2)红
(3)$Mg + H_{2}SO_{4} = MgSO_{4} + H_{2}\uparrow$
(4)$Al_{2}O_{3} + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}O$
(1)$H^{+}$
(2)红
(3)$Mg + H_{2}SO_{4} = MgSO_{4} + H_{2}\uparrow$
(4)$Al_{2}O_{3} + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}O$
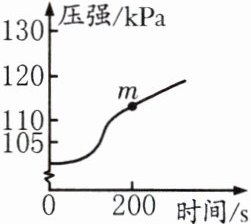
17. (河南中考)某化学兴趣小组的同学利用压强传感器、数据采集器和计算机等数字化实验设备,测定铝片与足量稀硫酸反应时气体压强的变化,实验结果如图所示。
(1)开始一段时间气体压强几乎不变,其原因是什么?
(2)写出m点时所发生反应的化学方程式。
(1)开始一段时间气体压强几乎不变,其原因是什么?
(2)写出m点时所发生反应的化学方程式。

答案:
答:
(1)铝表面的氧化铝与硫酸反应生成硫酸铝和水。
(2)$2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}\uparrow$。
(1)铝表面的氧化铝与硫酸反应生成硫酸铝和水。
(2)$2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}\uparrow$。
查看更多完整答案,请扫码查看


