2025年书立方跟踪测试卷九年级化学下册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年书立方跟踪测试卷九年级化学下册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第65页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
四、实验与探究题
13.某实验小组的同学在做酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入一定量的稀盐酸后,发现忘记了滴加酸碱指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
[提出问题]该烧杯内溶液中的溶质是什么?
[猜想]猜想一:只有CaCl₂;
猜想二:含有CaCl₂和HCl;
猜想三:含有CaCl₂和Ca(OH)₂;
猜想四:含有CaCl₂、HCl和Ca(OH)₂。
(1)同学们讨论后一致认为猜想四不合理,理由是______________________________;
[查阅资料]氯化钙溶液呈中性。
[进行实验]

(3)要使烧杯内溶液的溶质只含有CaCl₂,需要除去杂质,其中的一种方法是向烧杯中加入过量的某种物质,然后过滤,该除杂原理用化学方程式表示为______________________。
13.某实验小组的同学在做酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入一定量的稀盐酸后,发现忘记了滴加酸碱指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
[提出问题]该烧杯内溶液中的溶质是什么?
[猜想]猜想一:只有CaCl₂;
猜想二:含有CaCl₂和HCl;
猜想三:含有CaCl₂和Ca(OH)₂;
猜想四:含有CaCl₂、HCl和Ca(OH)₂。
(1)同学们讨论后一致认为猜想四不合理,理由是______________________________;
[查阅资料]氯化钙溶液呈中性。
[进行实验]

(3)要使烧杯内溶液的溶质只含有CaCl₂,需要除去杂质,其中的一种方法是向烧杯中加入过量的某种物质,然后过滤,该除杂原理用化学方程式表示为______________________。
答案:
(1)盐酸和氢氧化钙会发生反应
(2)黑色粉末减少或消失,溶液变为蓝色 镁(或其他活泼金属或少量碳酸钠溶液)等
(3)$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$
[解析]
(1)盐酸和氢氧化钙会反应生成氯化钙和水,所以盐酸与氢氧化钙不能共存,所以猜想四不合理。
(2)猜想二是成立的,所以溶液中含有$CaCl_{2}$和HCl;方案二取少量氧化铜粉末于试管中,加入一定量的烧杯中的溶液,氧化铜与盐酸反应生成氯化铜和水,所以实验现象为黑色粉末减少或消失,溶液变为蓝色;方案三的实验现象为产生气泡,而盐酸与氢前金属或碳酸盐反应都有气体生成,所以实验步骤为取少量烧杯中的溶液于另一支试管中,加入镁(或其他活泼金属)或少量碳酸钠溶液等。
(3)除去氯化钙中盐酸的方法是向烧杯中加入过量的碳酸钙,然后过滤,该除杂原理用化学方程式表示为$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$。
(1)盐酸和氢氧化钙会发生反应
(2)黑色粉末减少或消失,溶液变为蓝色 镁(或其他活泼金属或少量碳酸钠溶液)等
(3)$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$
[解析]
(1)盐酸和氢氧化钙会反应生成氯化钙和水,所以盐酸与氢氧化钙不能共存,所以猜想四不合理。
(2)猜想二是成立的,所以溶液中含有$CaCl_{2}$和HCl;方案二取少量氧化铜粉末于试管中,加入一定量的烧杯中的溶液,氧化铜与盐酸反应生成氯化铜和水,所以实验现象为黑色粉末减少或消失,溶液变为蓝色;方案三的实验现象为产生气泡,而盐酸与氢前金属或碳酸盐反应都有气体生成,所以实验步骤为取少量烧杯中的溶液于另一支试管中,加入镁(或其他活泼金属)或少量碳酸钠溶液等。
(3)除去氯化钙中盐酸的方法是向烧杯中加入过量的碳酸钙,然后过滤,该除杂原理用化学方程式表示为$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$。
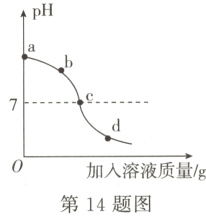
14.(2024·重庆中考)用NaOH溶液与稀硫酸进行中和反应实验,开始时滴入几滴酚酞溶液,测得溶液的pH变化如下图所示。下列说法不正确的是 ( )
A.图像表明是向NaOH溶液中加入稀硫酸
B.ac段溶液颜色逐渐变浅,d点溶液为无色
C.d点溶液钠元素质量分数大于b点溶液钠元素质量分数
D.ac段溶液升温明显高于cd段,说明该反应放出热量
A.图像表明是向NaOH溶液中加入稀硫酸
B.ac段溶液颜色逐渐变浅,d点溶液为无色
C.d点溶液钠元素质量分数大于b点溶液钠元素质量分数
D.ac段溶液升温明显高于cd段,说明该反应放出热量

答案:
C [解析]根据图示,初始溶液的pH>7,显碱性,随着另一溶液的加入,溶液的pH逐渐减小至小于7,则说明是向NaOH溶液中加入稀硫酸,故A说法正确;酚酞遇碱性溶液变红色,遇酸性和中性溶液不变色,氢氧化钠溶液显碱性,能使无色酚酞溶液变红色,随着稀硫酸的加入,稀硫酸和氢氧化钠反应生成硫酸钠和水,随着反应的进行,氢氧化钠不断被消耗,则ac段溶液颜色逐渐变浅,d点pH<7,显酸性,稀硫酸过量,此时溶液为无色,故B说法正确;根据质量守恒定律,反应过程中钠元素的质量不变,而d点溶液的质量>b点溶液的质量,则d点溶液钠元素质量分数小于b点溶液钠元素质量分数,故C说法不正确;ac段氢氧化钠和稀硫酸反应生成硫酸钠和水,c点时,溶液的pH=7,表示氢氧化钠和硫酸恰好完全反应,cd段溶液的pH<7,硫酸过量,ab段溶液升温明显高于cd段,说明该反应放出热量,故D说法正确。
查看更多完整答案,请扫码查看


