2025年书立方跟踪测试卷九年级化学下册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年书立方跟踪测试卷九年级化学下册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第21页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
1. 下列金属材料的运用与金属所具有的性质不一致的是 ( )
A. 制造白炽灯灯丝——熔点高
B. 制造飞机——坚硬而质轻
C. 制造保险丝——硬度大
D. 制造装化工原料的容器——耐腐蚀
A. 制造白炽灯灯丝——熔点高
B. 制造飞机——坚硬而质轻
C. 制造保险丝——硬度大
D. 制造装化工原料的容器——耐腐蚀
答案:
C【解析】A.做灯丝的材料不但要求能导电,而且要求熔点高,若熔点不够高则灯丝寿命不长,钨是所有金属中熔点最高的,最适合做灯丝,故A正确;
B.飞机在空中飞行,环境复杂,所以制造飞机的材料要坚硬而质轻,故B正确;
C.制造保险丝,关键是熔点低,电流超过正常范围,瞬间温度升高,在较低温度下就能够熔断,保护用电器不被烧毁,而不是需要金属的硬度大,故C错误;
D.化工原料一般具有腐蚀性,盛放的容器一定要耐腐蚀。所以制造装化工原料的容器一定要耐腐蚀,故D正确。
故选:C。
B.飞机在空中飞行,环境复杂,所以制造飞机的材料要坚硬而质轻,故B正确;
C.制造保险丝,关键是熔点低,电流超过正常范围,瞬间温度升高,在较低温度下就能够熔断,保护用电器不被烧毁,而不是需要金属的硬度大,故C错误;
D.化工原料一般具有腐蚀性,盛放的容器一定要耐腐蚀。所以制造装化工原料的容器一定要耐腐蚀,故D正确。
故选:C。
2. 下列关于金属和金属材料的说法中正确的是 ( )
A. 生铁和钢的含碳量不同
B. 黄铜比纯铜硬度小
C. 合金属于合成材料
D. 大多数金属在自然界中以单质形式存在
A. 生铁和钢的含碳量不同
B. 黄铜比纯铜硬度小
C. 合金属于合成材料
D. 大多数金属在自然界中以单质形式存在
答案:
A【解析】A.生铁和钢的含碳量不同,前者高于后者,A说法正确;
B.合金的硬度大于组成纯金属的硬度,因此黄铜比纯铜硬度大,B说法错误;
C.合金属于金属材料,合成材料包含塑料、合成橡胶和合成纤维,C说法错误;
D.大多数金属在自然界中以化合物的形式存在,只有少数很不活泼的金属元素如金等以单质形式存在,D说法错误。
故选:A。
B.合金的硬度大于组成纯金属的硬度,因此黄铜比纯铜硬度大,B说法错误;
C.合金属于金属材料,合成材料包含塑料、合成橡胶和合成纤维,C说法错误;
D.大多数金属在自然界中以化合物的形式存在,只有少数很不活泼的金属元素如金等以单质形式存在,D说法错误。
故选:A。
3. 湖南是有色金属之乡。下列有关金属和金属材料的说法正确的是 ( )
A. 合金的硬度比其各组分的硬度小
B. 生锈的金属材料没有回收的意义
C. 金属在自然界中都以单质形式存在
D. 生铁和钢是铁的两种合金
A. 合金的硬度比其各组分的硬度小
B. 生锈的金属材料没有回收的意义
C. 金属在自然界中都以单质形式存在
D. 生铁和钢是铁的两种合金
答案:
D【解析】A.一般,合金的硬度大于其组成中纯金属的硬度,黄铜是一种铜合金,因此黄铜的硬度比纯铜大,选项A说法错误;
B.回收生锈的金属材料既能节约资源,又能减少污染物的排放,有利于环境保护,选项B说法错误;
C.金属在自然界中不都以单质的形式存在,很多活泼金属在自然界中是以化合物的形式存在,选项C说法错误;
D.生铁和钢是铁的两种合金,选项D说法正确。
故选:D。
B.回收生锈的金属材料既能节约资源,又能减少污染物的排放,有利于环境保护,选项B说法错误;
C.金属在自然界中不都以单质的形式存在,很多活泼金属在自然界中是以化合物的形式存在,选项C说法错误;
D.生铁和钢是铁的两种合金,选项D说法正确。
故选:D。
4. 世界上每年因腐蚀而报废的金属设备和材料相当于金属年产量的20%~40%。下列防止铁生锈的方法错误的是 ( )
A. 在铁护栏表面涂上一层油漆
B. 菜刀用后洗净擦干
C. 用带油的布直接擦被雨水淋湿的自行车
D. 水龙头表面镀铬
A. 在铁护栏表面涂上一层油漆
B. 菜刀用后洗净擦干
C. 用带油的布直接擦被雨水淋湿的自行车
D. 水龙头表面镀铬
答案:
C【解析】A.在铁护栏表面涂上一层油漆,可以隔绝氧气和水,从而防止铁生锈,故A正确;
B.菜刀用后洗净擦干,可以减少与水的接触,可以防止铁生锈,故B正确;
C.用带油的布直接擦被雨水淋湿的自行车,不能完全擦干,油膜不能完全隔绝铁与氧气、水的接触,不能防止铁生锈,故C不正确;
D.水龙头表面镀铬,可以隔绝氧气和水,可以防止铁生锈,故D正确。
故选:C。
B.菜刀用后洗净擦干,可以减少与水的接触,可以防止铁生锈,故B正确;
C.用带油的布直接擦被雨水淋湿的自行车,不能完全擦干,油膜不能完全隔绝铁与氧气、水的接触,不能防止铁生锈,故C不正确;
D.水龙头表面镀铬,可以隔绝氧气和水,可以防止铁生锈,故D正确。
故选:C。
5. 有关金属的实验如下,能达到相应目的的是 ( )


答案:
B【解析】不锈钢的组分金属是铁,不是铝,所以不锈钢在铝片上刻画不能比较合金与其组分金属的硬度,A不能达到相应目的,不符合题意;由于铜片与硫酸亚铁溶液不反应,所以金属的活动性铜<铁;锌粒能与硫酸亚铁反应生成硫酸锌和铁,所以金属的活动性锌>铁。即锌、铁和铜的金属活动性顺序是锌>铁>铜,B能达到相应目的,符合题意;铜生锈主要是铜与空气中的氧气、二氧化碳和水共同作用的结果,实验中缺少验证铜片只与干燥的二氧化碳和氧气接触,铜片是否生锈,C不能达到相应目的,不符合题意;由于铁片与稀硫酸反应生成硫酸亚铁和氢气,所以用铁片与稀硫酸反应验证质量守恒定律应在密闭装置内进行。实验中烧杯不是密闭装置,D不能达到相应目的,不符合题意。
6. 某同学绘制了含铁元素的部分物质转化关系图(图中“→”表示一种物质可以转化为另一种物质,部分反应物、生成物及反应条件已略去),下列说法正确的是 ( )

A. 铁丝能在空气中剧烈燃烧实现转化①
B. 转化②可通过Fe₃O₄与CO发生置换反应实现
C. 转化③也可以有利于人类
D. 通过Fe与ZnSO₄溶液反应可实现转化④

A. 铁丝能在空气中剧烈燃烧实现转化①
B. 转化②可通过Fe₃O₄与CO发生置换反应实现
C. 转化③也可以有利于人类
D. 通过Fe与ZnSO₄溶液反应可实现转化④
答案:
C【解析】A.铁丝不能在空气中燃烧,该选项不正确。
B.置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,②可通过一氧化碳和四氧化三铁在高温下反应生成铁和二氧化碳实现,该反应的反应物是两种化合物,不属于置换反应,该选项不正确。
C.③为铁生锈,铁生锈可以吸收氧气和水蒸气,可用作双吸剂,用于食品防腐,也可以有利于人类,该选项正确。
D.Fe比Zn的活动性弱,故Fe与ZnSO₄溶液不能反应,该选项不正确。
故选:C。
B.置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,②可通过一氧化碳和四氧化三铁在高温下反应生成铁和二氧化碳实现,该反应的反应物是两种化合物,不属于置换反应,该选项不正确。
C.③为铁生锈,铁生锈可以吸收氧气和水蒸气,可用作双吸剂,用于食品防腐,也可以有利于人类,该选项正确。
D.Fe比Zn的活动性弱,故Fe与ZnSO₄溶液不能反应,该选项不正确。
故选:C。
7. 在CuCl₂和MgCl₂的混合溶液中,加入过量的铁粉,充分反应后过滤,留在滤纸上的物质是 ( )
A. Fe
B. Cu
C. Mg
D. Fe和Cu
A. Fe
B. Cu
C. Mg
D. Fe和Cu
答案:
D【解析】由于在金属活动性顺序中,铁的金属活动性比铜强但比镁弱,因此铁可以和铜盐溶液反应,但不能和镁盐溶液反应;由于铁和氯化铜溶液反应生成金属铜和氯化亚铁溶液,因此留在滤纸上的物质是生成的金属铜和过量的铁。
故选:D。
故选:D。
8. 下列各组试剂不能验证铁、铜、银三种金属活动性强弱的是 ( )
A. CuSO₄溶液、Fe、Ag
B. FeSO₄溶液、稀H₂SO₄、Cu、Ag
C. AgNO₃溶液、稀H₂SO₄、Fe、Cu
D. AgNO₃溶液、FeSO₄溶液、Cu
A. CuSO₄溶液、Fe、Ag
B. FeSO₄溶液、稀H₂SO₄、Cu、Ag
C. AgNO₃溶液、稀H₂SO₄、Fe、Cu
D. AgNO₃溶液、FeSO₄溶液、Cu
答案:
B【解析】A.铁能与CuSO₄溶液反应置换出铜,说明了金属活动性铁>铜;银和CuSO₄溶液不反应,说明了金属活动性铜>银;可得出三种金属活动性铁>铜>银,故A选项错误。
B.Cu、Ag与FeSO₄溶液、稀H₂SO₄均不反应,说明了金属活动性铁>铜,铁>银,但无法确定银和铜的活动性强弱,故B选项正确。
C.Fe能与稀H₂SO₄反应生成氢气,铜不能与稀H₂SO₄反应,说明活动性即铁>氢>铜;铜能与硝酸银溶液置换出银,说明了金属活动性铜>银;可得出三种金属活动性铁>铜>银,故C选项错误。
D.铜能与硝酸银溶液置换出银,说明了金属活动性铜>银;铜不能与FeSO₄溶液反应,说明了金属活动性铁>铜;可得出三种金属活动性铁>铜>银,故D选项错误。
故选:B。
B.Cu、Ag与FeSO₄溶液、稀H₂SO₄均不反应,说明了金属活动性铁>铜,铁>银,但无法确定银和铜的活动性强弱,故B选项正确。
C.Fe能与稀H₂SO₄反应生成氢气,铜不能与稀H₂SO₄反应,说明活动性即铁>氢>铜;铜能与硝酸银溶液置换出银,说明了金属活动性铜>银;可得出三种金属活动性铁>铜>银,故C选项错误。
D.铜能与硝酸银溶液置换出银,说明了金属活动性铜>银;铜不能与FeSO₄溶液反应,说明了金属活动性铁>铜;可得出三种金属活动性铁>铜>银,故D选项错误。
故选:B。
9. 以下实验现象,正确的是 ( )

A. 如图甲,通入硫酸铜溶液后,可以用铁把铜析出
B. 反应后电子秤的示数为230.5 g
C. 对比实验乙的①③:可以探究接触空气是否是铁生锈的条件之一
D. 图乙一周过后,②铁钉产生的铁锈最多

A. 如图甲,通入硫酸铜溶液后,可以用铁把铜析出
B. 反应后电子秤的示数为230.5 g
C. 对比实验乙的①③:可以探究接触空气是否是铁生锈的条件之一
D. 图乙一周过后,②铁钉产生的铁锈最多
答案:
B【解析】A.甲实验中,根据金属活动性铁>铜,铁与硫酸铜反应生成铜和硫酸亚铁,实验现象为有红色固体析出,故A错误;
B.甲实验中,根据金属活动性铁>铜,铁与硫酸铜反应生成铜和硫酸亚铁,该反应遵守质量守恒定律,所以反应前后物质总质量不变,则反应后电子秤的示数为230.5g,故B正确;
C.实验乙中,①号试管中铁钉同时与水和氧气接触,生锈;②号试管中铁钉只与水接触,不生锈;③号试管中铁钉只与空气接触,不生锈;对比①③可以探究铁生锈的条件之一是与水接触,故C错误;
D.由上可知,图乙一周过后,①铁钉产生的铁锈最多,故D错误。
故选:B。
B.甲实验中,根据金属活动性铁>铜,铁与硫酸铜反应生成铜和硫酸亚铁,该反应遵守质量守恒定律,所以反应前后物质总质量不变,则反应后电子秤的示数为230.5g,故B正确;
C.实验乙中,①号试管中铁钉同时与水和氧气接触,生锈;②号试管中铁钉只与水接触,不生锈;③号试管中铁钉只与空气接触,不生锈;对比①③可以探究铁生锈的条件之一是与水接触,故C错误;
D.由上可知,图乙一周过后,①铁钉产生的铁锈最多,故D错误。
故选:B。
10. 将一定质量的铁粉放入硝酸锌和硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液。下列说法正确的是 ( )
A. 若滤液呈浅绿色,则滤液中只含有硝酸亚铁
B. 若滤渣中的成分能被磁铁吸引,则滤渣中一定含有两种金属
C. 若向滤液中加入锌片,有固体析出,则滤液中一定含有硝酸银
D. 将所得滤渣洗涤、干燥后称量,质量可能与所加铁粉的质量相等
A. 若滤液呈浅绿色,则滤液中只含有硝酸亚铁
B. 若滤渣中的成分能被磁铁吸引,则滤渣中一定含有两种金属
C. 若向滤液中加入锌片,有固体析出,则滤液中一定含有硝酸银
D. 将所得滤渣洗涤、干燥后称量,质量可能与所加铁粉的质量相等
答案:
B【解析】A.铁不能和硝酸锌反应,铁和硝酸银反应生成硝酸亚铁和银,硝酸亚铁在溶液中显浅绿色,若滤液呈浅绿色,则滤液中一定含有生成的硝酸亚铁和不参与反应的硝酸锌,故A选项说法不正确。
B.铁和硝酸银反应生成硝酸亚铁和银,一定有银生成,若滤渣中的成分能被磁铁吸引,则滤渣中还有铁,所以滤渣中一定含有银和铁两种金属,故B选项说法正确。
C.铁和硝酸银反应生成硝酸亚铁和银,锌和硝酸亚铁反应生成铁和硝酸锌,若向滤液中加入锌片,有固体析出,不能说明滤液中一定含有硝酸银,因为滤液中一定有生成的硝酸亚铁,析出的固体可能是锌和硝酸亚铁反应生成的铁,故C选项说法不正确。
D.铁和硝酸银反应生成硝酸亚铁和银,由反应的化学方程式Fe + 2AgNO₃ = Fe(NO₃)₂ + 2Ag可知,每56份质量的铁完全反应能置换出216份质量的银,反应后固体质量变大,所以将所得滤渣洗涤、干燥后称量,质量一定大于所加铁粉的质量,故D选项说法不正确。
故选:B。
B.铁和硝酸银反应生成硝酸亚铁和银,一定有银生成,若滤渣中的成分能被磁铁吸引,则滤渣中还有铁,所以滤渣中一定含有银和铁两种金属,故B选项说法正确。
C.铁和硝酸银反应生成硝酸亚铁和银,锌和硝酸亚铁反应生成铁和硝酸锌,若向滤液中加入锌片,有固体析出,不能说明滤液中一定含有硝酸银,因为滤液中一定有生成的硝酸亚铁,析出的固体可能是锌和硝酸亚铁反应生成的铁,故C选项说法不正确。
D.铁和硝酸银反应生成硝酸亚铁和银,由反应的化学方程式Fe + 2AgNO₃ = Fe(NO₃)₂ + 2Ag可知,每56份质量的铁完全反应能置换出216份质量的银,反应后固体质量变大,所以将所得滤渣洗涤、干燥后称量,质量一定大于所加铁粉的质量,故D选项说法不正确。
故选:B。
11. 用化学符号表示:
(1)铝原子______;
(2)2个铝离子______;
(3)硫酸铝______。
(1)铝原子______;
(2)2个铝离子______;
(3)硫酸铝______。
答案:
(1)Al
(2)2Al³⁺
(3)Al₂(SO₄)₃
(1)Al
(2)2Al³⁺
(3)Al₂(SO₄)₃
12. 金属材料与人类的生产生活密切相关。请回答:
(1)铁可以做成铁锅炒菜,这是利用了铁的______性;
(2)但是铁容易生锈,这是因为铁和空气中的______和水蒸气接触;铝具有更好的抗腐蚀性能,其原因为______;
(3)向硝酸铜和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,得到滤渣和滤液。向滤渣中滴加稀盐酸,无气泡产生,则可推知滤液中一定含有的溶质是______(填化学式)。
(1)铁可以做成铁锅炒菜,这是利用了铁的______性;
(2)但是铁容易生锈,这是因为铁和空气中的______和水蒸气接触;铝具有更好的抗腐蚀性能,其原因为______;
(3)向硝酸铜和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,得到滤渣和滤液。向滤渣中滴加稀盐酸,无气泡产生,则可推知滤液中一定含有的溶质是______(填化学式)。
答案:
(1)导热性
(2)氧气(或空气) 铝与氧气在常温下反应生成致密的氧化铝薄膜
(3)Fe(NO₃)₂
【解析】
(1)铁可以做成铁锅炒菜,这是利用了铁的导热性;
(2)铁容易生锈,这是因为铁和空气中的氧气(或空气)和水蒸气接触,铝具有更好的抗腐蚀性能,是因为铝与氧气在常温下反应生成致密的氧化铝薄膜;
(3)将一定质量的铁粉加入硝酸铜和硝酸银的混合溶液中,则铁先与硝酸银反应生成硝酸亚铁和银,硝酸银完全反应后,铁再与硝酸铜反应生成硝酸亚铁和铜,充分反应后过滤,得到滤液和滤渣。向滤渣中滴加稀盐酸,无气泡产生,说明铁无剩余,则可推知滤液中一定含有的溶质是Fe(NO₃)₂,硝酸银和硝酸铜可能有。
(1)导热性
(2)氧气(或空气) 铝与氧气在常温下反应生成致密的氧化铝薄膜
(3)Fe(NO₃)₂
【解析】
(1)铁可以做成铁锅炒菜,这是利用了铁的导热性;
(2)铁容易生锈,这是因为铁和空气中的氧气(或空气)和水蒸气接触,铝具有更好的抗腐蚀性能,是因为铝与氧气在常温下反应生成致密的氧化铝薄膜;
(3)将一定质量的铁粉加入硝酸铜和硝酸银的混合溶液中,则铁先与硝酸银反应生成硝酸亚铁和银,硝酸银完全反应后,铁再与硝酸铜反应生成硝酸亚铁和铜,充分反应后过滤,得到滤液和滤渣。向滤渣中滴加稀盐酸,无气泡产生,说明铁无剩余,则可推知滤液中一定含有的溶质是Fe(NO₃)₂,硝酸银和硝酸铜可能有。
13. “天津之眼”是世界上唯一一座跨河而建、桥轮合一的摩天轮。
(1)“天津之眼”主要采用钢材制造。钢是铁碳合金,钢的硬度比纯铁______(填“大”或“小”);
(2)铁可以做成铁板、铁丝,主要是利用了铁的______性;
(3)同学们为探究铁锈蚀的影响因素做了如下实验。下列分析不正确的是______。
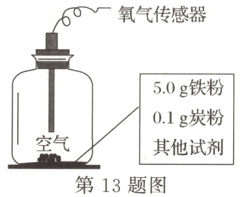

A. ②③中氧气含量减少表明铁已生锈
B. ①②证明水对铁锈蚀有影响
C. ②③证明食盐能加快铁锈蚀
D. ①②③证明炭粉对铁锈蚀有影响
(1)“天津之眼”主要采用钢材制造。钢是铁碳合金,钢的硬度比纯铁______(填“大”或“小”);
(2)铁可以做成铁板、铁丝,主要是利用了铁的______性;
(3)同学们为探究铁锈蚀的影响因素做了如下实验。下列分析不正确的是______。


A. ②③中氧气含量减少表明铁已生锈
B. ①②证明水对铁锈蚀有影响
C. ②③证明食盐能加快铁锈蚀
D. ①②③证明炭粉对铁锈蚀有影响
答案:
(1)大
(2)延展
(3)D
【解析】
(1)合金的硬度大于组成的纯金属硬度,钢是铁碳合金,钢的硬度比纯铁大;
(2)铁可以做成铁板、铁丝,主要是利用了铁的延展性;
(3)A.铁生锈是铁与氧气、水共同作用的结果,根据表格数据可知实验②③中含量减少,表明铁已锈蚀,故A选项说法正确;
B.根据表格数据可知实验①中的氧气含量不变,实验②中的氧气含量减少,对比①②组实验数据可知水为变量,则证明水对铁锈蚀有影响,故B选项说法正确;
C.对比②③组实验数据可知食盐为变量,实验③中加入1g食盐,氧气消耗的速率加快,则生锈速率加快,可以证明食盐能加快铁锈蚀,故C选项说法正确;
D.实验①②③中炭粉都不是变量,则无法证明炭粉对铁锈蚀有影响,故D选项说法错误。
故选D。
(1)大
(2)延展
(3)D
【解析】
(1)合金的硬度大于组成的纯金属硬度,钢是铁碳合金,钢的硬度比纯铁大;
(2)铁可以做成铁板、铁丝,主要是利用了铁的延展性;
(3)A.铁生锈是铁与氧气、水共同作用的结果,根据表格数据可知实验②③中含量减少,表明铁已锈蚀,故A选项说法正确;
B.根据表格数据可知实验①中的氧气含量不变,实验②中的氧气含量减少,对比①②组实验数据可知水为变量,则证明水对铁锈蚀有影响,故B选项说法正确;
C.对比②③组实验数据可知食盐为变量,实验③中加入1g食盐,氧气消耗的速率加快,则生锈速率加快,可以证明食盐能加快铁锈蚀,故C选项说法正确;
D.实验①②③中炭粉都不是变量,则无法证明炭粉对铁锈蚀有影响,故D选项说法错误。
故选D。
14. 《天工开物》记载“凡钟为金乐之首”,在古代的金属乐器之中,钟是最重要的乐器。铸钟的材料,铜为上等,铁为下等。
(1)古代炼铜的方法之一是用铁与硫酸铜溶液反应,该反应的化学方程式为______;
(2)此反应的发生,表现出铁与铜的金属活动性强弱关系是______。
(1)古代炼铜的方法之一是用铁与硫酸铜溶液反应,该反应的化学方程式为______;
(2)此反应的发生,表现出铁与铜的金属活动性强弱关系是______。
答案:
(1)Fe + CuSO₄ = FeSO₄ + Cu
(2)铁比铜活泼
【解析】
(1)铁与硫酸铜反应生成硫酸亚铁和铜,该反应的化学方程式为Fe + CuSO₄ = FeSO₄ + Cu。
(2)此反应的发生,表现出铁与铜的金属活动性强弱关系是铁比铜活泼。
(1)Fe + CuSO₄ = FeSO₄ + Cu
(2)铁比铜活泼
【解析】
(1)铁与硫酸铜反应生成硫酸亚铁和铜,该反应的化学方程式为Fe + CuSO₄ = FeSO₄ + Cu。
(2)此反应的发生,表现出铁与铜的金属活动性强弱关系是铁比铜活泼。
15. 太阳能电池路灯,可以实现白天用太阳能充电,夜晚照明,其灯柱材料为铝合金,路灯内部采用金属铜作导线。回答下列问题:
(1)制作灯柱所需的铝合金属于______(选填“金属材料”或“合成材料”);
(2)铝合金的硬度和强度都比纯铝______(选填“高”或“低”);
(3)太阳能电池路灯使用铜作导线,是因为铜具有良好的______性。
(1)制作灯柱所需的铝合金属于______(选填“金属材料”或“合成材料”);
(2)铝合金的硬度和强度都比纯铝______(选填“高”或“低”);
(3)太阳能电池路灯使用铜作导线,是因为铜具有良好的______性。
答案:
(1)金属材料
(2)高
(3)导电
(1)金属材料
(2)高
(3)导电
16. 铜是重要的金属资源,它对于改善人类生活、促进人类文明起着重要作用。
(1)铜的认识:生活中常用铜作导线;
(2)铜的冶炼:黄铜矿的主要成分是CuFeS₂,根据其主要成分的组成元素,推断用黄铜矿炼铜过程中产生形成酸雨的空气污染物是______(填化学式);
|物质|A|B|
| ---- | ---- | ---- |
|硬度|2.5 - 3|5 - 6.6|
(3)铜的加工:青铜是金属冶铸史上最早的合金,其主要成分是铜和锡。表中的A和B分别表示铜和青铜中的一种。《吕氏春秋》记载:“金(铜)柔锡柔,合两柔则刚”,据此判断A是______;
(4)铜的锈蚀:铜在潮湿的空气中锈蚀的反应为2Cu+O₂+H₂O+X=Cu₂(OH)₂CO₃,X的化学式为______。
(1)铜的认识:生活中常用铜作导线;
(2)铜的冶炼:黄铜矿的主要成分是CuFeS₂,根据其主要成分的组成元素,推断用黄铜矿炼铜过程中产生形成酸雨的空气污染物是______(填化学式);
|物质|A|B|
| ---- | ---- | ---- |
|硬度|2.5 - 3|5 - 6.6|
(3)铜的加工:青铜是金属冶铸史上最早的合金,其主要成分是铜和锡。表中的A和B分别表示铜和青铜中的一种。《吕氏春秋》记载:“金(铜)柔锡柔,合两柔则刚”,据此判断A是______;
(4)铜的锈蚀:铜在潮湿的空气中锈蚀的反应为2Cu+O₂+H₂O+X=Cu₂(OH)₂CO₃,X的化学式为______。
答案:
(2)SO₂
(3)铜/Cu
(4)CO₂
【解析】
(2)根据质量守恒定律,化学反应前后,元素的种类不变,黄铜矿中含硫元素,则黄铜矿炼铜过程中产生形成酸雨的空气污染物是SO₂;
(3)“金(铜)柔锡柔,合两柔则刚”,说明合金比组成它的纯金属硬度大,A的硬度小,故A是铜;
(4)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Cu、O、H、C的个数分别是2、3、2、0,生成物中含Cu、O、H、C的个数分别是2、5、2、1,故反应物中还应含2个O、1个C,故X的化学式为CO₂;
(2)SO₂
(3)铜/Cu
(4)CO₂
【解析】
(2)根据质量守恒定律,化学反应前后,元素的种类不变,黄铜矿中含硫元素,则黄铜矿炼铜过程中产生形成酸雨的空气污染物是SO₂;
(3)“金(铜)柔锡柔,合两柔则刚”,说明合金比组成它的纯金属硬度大,A的硬度小,故A是铜;
(4)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Cu、O、H、C的个数分别是2、3、2、0,生成物中含Cu、O、H、C的个数分别是2、5、2、1,故反应物中还应含2个O、1个C,故X的化学式为CO₂;
17. 2024年5月1日,我国完全自主设计建造的首艘弹射型航母“福建舰”开展首次航行试验。
(1)建造航母用到钛合金,钛合金放到海水中数年,取出后仍光亮如初,体现钛合金具有非常好的______性能;
(2)航母飞行甲板钢板表面镀有镍等金属。镍(Ni)的金属活动性介于铁和锡之间,化合物中镍元素通常显+2价。写出Ni与CuSO₄溶液反应的化学方程式______。
(1)建造航母用到钛合金,钛合金放到海水中数年,取出后仍光亮如初,体现钛合金具有非常好的______性能;
(2)航母飞行甲板钢板表面镀有镍等金属。镍(Ni)的金属活动性介于铁和锡之间,化合物中镍元素通常显+2价。写出Ni与CuSO₄溶液反应的化学方程式______。
答案:
(1)抗腐蚀
(2)Ni + CuSO₄ = NiSO₄ + Cu
【解析】
(1)建造航母用到钛合金,钛合金放到海水中数年,取出后仍光亮如初,体现钛合金具有非常好的抗腐蚀性能;
(2)Ni的金属活动性介于铁和锡之间,则Ni能与CuSO₄溶液反应生成硫酸镍和铜,Ni与CuSO₄溶液反应的化学方程式为:Ni + CuSO₄ = NiSO₄ + Cu
(1)抗腐蚀
(2)Ni + CuSO₄ = NiSO₄ + Cu
【解析】
(1)建造航母用到钛合金,钛合金放到海水中数年,取出后仍光亮如初,体现钛合金具有非常好的抗腐蚀性能;
(2)Ni的金属活动性介于铁和锡之间,则Ni能与CuSO₄溶液反应生成硫酸镍和铜,Ni与CuSO₄溶液反应的化学方程式为:Ni + CuSO₄ = NiSO₄ + Cu
18. 为验证铁、铜、银的金属活动性顺序,某同学设计了以下四组实验。回答下列问题。

(1)①、②、③中有明显实验现象的是______(填序号);
(2)通过实验①和②,能验证金属活动性:Fe______(填“>”或“<”)Cu;
(3)通过实验①、②、③______(填“能”或“不能”)验证金属活动性:Fe>Cu>Ag;
(4)为达到实验目的,实验④中a、b物质发生反应的化学方程式为______。

(1)①、②、③中有明显实验现象的是______(填序号);
(2)通过实验①和②,能验证金属活动性:Fe______(填“>”或“<”)Cu;
(3)通过实验①、②、③______(填“能”或“不能”)验证金属活动性:Fe>Cu>Ag;
(4)为达到实验目的,实验④中a、b物质发生反应的化学方程式为______。
答案:
(1)①③
(2)>
(3)不能
(4)Cu + 2AgNO₃ = 2Ag + Cu(NO₃)₂
【解析】
(1)实验①铁与硫酸反应生成硫酸亚铁和氢气,有气泡产生,实验②铜与硫酸不反应,没有明显现象,实验③铁与硝酸银反应生成硝酸亚铁和铜,铁表面出现银白色固体,溶液变成浅绿色。
(2)实验①铁与硫酸反应生成硫酸亚铁和氢气,实验②铜与硫酸不反应,则金属活动性Fe>(H)>Cu。
(3)实验①铁与硫酸能反应,实验②铜与硫酸不反应,说明铁的活动性比铜强,实验③铁与硝酸银能反应,说明铁的活动性比银强,无法比较铜、银活动性的强弱,则通过实验①、②、③,不能验证金属活动性:Fe>Cu>Ag。
(4)要验证金属活动性:Fe>Cu>Ag,实验④只需证明铜的活动性强于银即可,则a、b为Cu、AgNO₃溶液或Ag、Cu(NO₃)₂溶液,则a为Cu,b为AgNO₃溶液,化学方程式为Cu + 2AgNO₃ = 2Ag + Cu(NO₃)₂。
(1)①③
(2)>
(3)不能
(4)Cu + 2AgNO₃ = 2Ag + Cu(NO₃)₂
【解析】
(1)实验①铁与硫酸反应生成硫酸亚铁和氢气,有气泡产生,实验②铜与硫酸不反应,没有明显现象,实验③铁与硝酸银反应生成硝酸亚铁和铜,铁表面出现银白色固体,溶液变成浅绿色。
(2)实验①铁与硫酸反应生成硫酸亚铁和氢气,实验②铜与硫酸不反应,则金属活动性Fe>(H)>Cu。
(3)实验①铁与硫酸能反应,实验②铜与硫酸不反应,说明铁的活动性比铜强,实验③铁与硝酸银能反应,说明铁的活动性比银强,无法比较铜、银活动性的强弱,则通过实验①、②、③,不能验证金属活动性:Fe>Cu>Ag。
(4)要验证金属活动性:Fe>Cu>Ag,实验④只需证明铜的活动性强于银即可,则a、b为Cu、AgNO₃溶液或Ag、Cu(NO₃)₂溶液,则a为Cu,b为AgNO₃溶液,化学方程式为Cu + 2AgNO₃ = 2Ag + Cu(NO₃)₂。
19. (2024·泸州中考)《化学(九年级下册)》“多识一点”有如下介绍:铝在常温下很容易跟氧气发生反应,生成一层致密而坚固的氧化铝薄膜。据此,某课外学习小组开展了系列性质探究予以证明。已知熔点:铝660℃,氧化铝2054℃;沸点:铝2327℃。回答相关问题:
【实验1】如图,用火焰喷枪的火焰(温度800~1300℃)从下往上灼烧铝片,观察到下端形成膨胀状态的“小泡”。

(1)铝在常温下跟氧气发生反应______(填基本反应类型);
(2)形成膨胀“小泡”现象既能证明______,还能证明铝的熔点低于氧化铝,“小泡”内装的铝呈______态;
【实验2】将铝片浸入8% CuSO₄溶液中。
(3)开始1 min内无明显现象,该事实______(选填“能”或“不能”)证明氧化铝薄膜的致密性;
(4)2 min左右铝片表面逐渐产生气泡并析出红色物质。收集气体检验,易燃,则气体是______,写出生成红色物质的化学方程式______。
【实验1】如图,用火焰喷枪的火焰(温度800~1300℃)从下往上灼烧铝片,观察到下端形成膨胀状态的“小泡”。

(1)铝在常温下跟氧气发生反应______(填基本反应类型);
(2)形成膨胀“小泡”现象既能证明______,还能证明铝的熔点低于氧化铝,“小泡”内装的铝呈______态;
【实验2】将铝片浸入8% CuSO₄溶液中。
(3)开始1 min内无明显现象,该事实______(选填“能”或“不能”)证明氧化铝薄膜的致密性;
(4)2 min左右铝片表面逐渐产生气泡并析出红色物质。收集气体检验,易燃,则气体是______,写出生成红色物质的化学方程式______。
答案:
(1)化合
(2)铝能和氧气反应生成致密坚固的氧化铝薄膜 液
(3)不能
(4)氢气/H₂ 2Al + 3CuSO₄ = Al₂(SO₄)₃ + 3Cu
【解析】
(1)铝在常温下跟氧气反应生成氧化铝,该反应是由两种物质生成一种物质的反应,该反应基本反应类型属于化合反应。
(2)用火焰喷枪的火焰从下往上灼烧铝片,观察到下端形成膨胀状态的“小泡”,说明外边的一层物质并没有与氧气反应,这是由于铝与空气中的氧气反应生成的氧化铝是一层致密坚固的薄膜,膜内熔化的液体渐渐汇集流入下面的包裹膜内说明铝的熔点比氧化铝的熔点低。
(3)开始1min内无明显现象,该事实不能证明氧化铝薄膜的致密性,欲证明氧化铝薄膜的致密性,需将表面打磨的铝片和将表面未打磨的铝片分别浸入8%CuSO₄溶液中,在1min内进行对比。
(4)铝的金属活动性比铜强,2min铝片表面逐渐产生气泡并析出红色物质,铜的颜色是红色,说明铝与硫酸铜反应生成铜和硫酸铝,该反应的化学方程式为2Al + 3CuSO₄ = Al₂(SO₄)₃ + 3Cu;收集气体检验,易燃,根据质量守恒定律,化学反应前后元素种类不变,易燃气体是氢气。
(1)化合
(2)铝能和氧气反应生成致密坚固的氧化铝薄膜 液
(3)不能
(4)氢气/H₂ 2Al + 3CuSO₄ = Al₂(SO₄)₃ + 3Cu
【解析】
(1)铝在常温下跟氧气反应生成氧化铝,该反应是由两种物质生成一种物质的反应,该反应基本反应类型属于化合反应。
(2)用火焰喷枪的火焰从下往上灼烧铝片,观察到下端形成膨胀状态的“小泡”,说明外边的一层物质并没有与氧气反应,这是由于铝与空气中的氧气反应生成的氧化铝是一层致密坚固的薄膜,膜内熔化的液体渐渐汇集流入下面的包裹膜内说明铝的熔点比氧化铝的熔点低。
(3)开始1min内无明显现象,该事实不能证明氧化铝薄膜的致密性,欲证明氧化铝薄膜的致密性,需将表面打磨的铝片和将表面未打磨的铝片分别浸入8%CuSO₄溶液中,在1min内进行对比。
(4)铝的金属活动性比铜强,2min铝片表面逐渐产生气泡并析出红色物质,铜的颜色是红色,说明铝与硫酸铜反应生成铜和硫酸铝,该反应的化学方程式为2Al + 3CuSO₄ = Al₂(SO₄)₃ + 3Cu;收集气体检验,易燃,根据质量守恒定律,化学反应前后元素种类不变,易燃气体是氢气。
20. 生铁和钢都是铁和碳的合金,生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。化学兴趣小组同学为确定某合金是生铁还是钢,他们取该合金样品5.7 g(假设只含铁单质及碳单质),加入稀硫酸至不再产生气体为止,反应过程中生成的气体与所加稀硫酸的质量关系如图所示。请分析并计算:
(1)生成氢气的质量为______g。
(2)请通过计算确定该铁合金是生铁还是钢。(写出计算过程,计算结果精确到0.1%)

(1)生成氢气的质量为______g。
(2)请通过计算确定该铁合金是生铁还是钢。(写出计算过程,计算结果精确到0.1%)

答案:
(1)0.2
(2)钢
【解析】
(1)由图可知,生成氢气的质量为0.2g。
(2)解:设该铁合金中铁的质量为x。
Fe + H₂SO₄ = FeSO₄ + H₂↑
56 2
x 0.2g
$\frac{56}{2}$ = $\frac{x}{0.2g}$
x = 5.6g
则该合金的含碳量为:$\frac{5.7g - 5.6g}{5.7g}$×100%≈1.8%
生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%,故该铁合金为钢。
(1)0.2
(2)钢
【解析】
(1)由图可知,生成氢气的质量为0.2g。
(2)解:设该铁合金中铁的质量为x。
Fe + H₂SO₄ = FeSO₄ + H₂↑
56 2
x 0.2g
$\frac{56}{2}$ = $\frac{x}{0.2g}$
x = 5.6g
则该合金的含碳量为:$\frac{5.7g - 5.6g}{5.7g}$×100%≈1.8%
生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%,故该铁合金为钢。
查看更多完整答案,请扫码查看


