2025年活动单导学课程高中化学选择性必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年活动单导学课程高中化学选择性必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第74页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
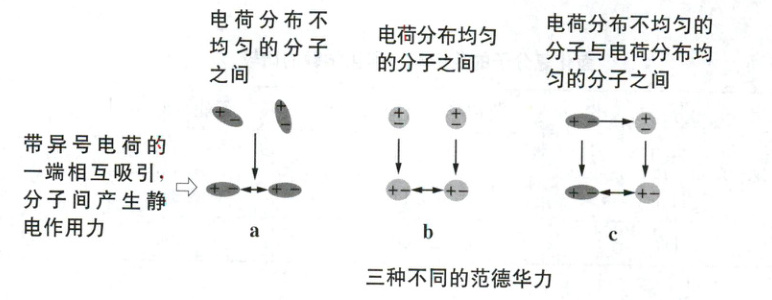
3. 阅读拓展视野,范德华力包括几种?你认为这种作用力本质是什么作用力?

答案:
3.范德华力包括三种。本质上也是分子之间的静电作用力。
活动三:认识氢键
1. 如图是一些氢化物的沸点,结合所学范德华力,讨论是否有什么反常?
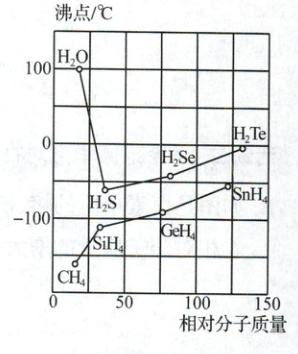
一些氢化物的沸点
1. 如图是一些氢化物的沸点,结合所学范德华力,讨论是否有什么反常?

一些氢化物的沸点
答案:
1.水分子的相对分子质量小于硫化氢,理论上硫化氢的沸点应高于水,实际水的沸点高于硫化氢,出现反常。
2. 阅读教材,讨论水分子中$H$原子为什么几乎成了“裸露”的质子?水分子间的氢键是如何形成的?
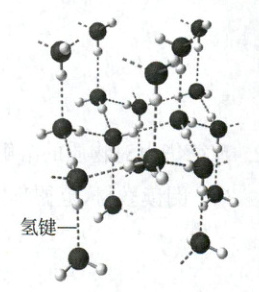
水分子之间形成氢键的示意图

水分子之间形成氢键的示意图
答案:
2.水分子中的O—H键是极性共价键,氧原子与氢原子共用的电子对强烈地偏向氧原子,使H原子几乎成了“裸露”的质子。这样,一个水分子中相对显正电性的氢原子,就能与另一个水分子中相对显负电性的氧原子的孤电子对接近并产生相互作用,这种相互作用叫作氢键(hydrogen bond)。
3. 阅读教材的方法导引,了解氢键的形成、表示方法和氢键的作用力大小。
(1) 氢键有哪几种类型?氢键的作用力大小如何?
(2) 氢键是如何形成的?如何表示氢键?哪些原子间易形成氢键?
(3) 讨论氢键是否属于化学键?是否有饱和性和方向性?
(1) 氢键有哪几种类型?氢键的作用力大小如何?
(2) 氢键是如何形成的?如何表示氢键?哪些原子间易形成氢键?
(3) 讨论氢键是否属于化学键?是否有饱和性和方向性?
答案:
3.
(1)氢键有分子内氢键和分子间氢键两种,氢键比化学键弱,比范德华力强。
(2)H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y的孤电子对接近并产生相互作用,即形成氢键,通常用X—H⋯Y表示。其中X、Y代表电负性大而原子半径较小的非金属原子,如氟、氧、氮原子。
(3)氢键不属于化学键,但有方向性和饱和性。
(1)氢键有分子内氢键和分子间氢键两种,氢键比化学键弱,比范德华力强。
(2)H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y的孤电子对接近并产生相互作用,即形成氢键,通常用X—H⋯Y表示。其中X、Y代表电负性大而原子半径较小的非金属原子,如氟、氧、氮原子。
(3)氢键不属于化学键,但有方向性和饱和性。
查看更多完整答案,请扫码查看


