2025年活动单导学课程高中化学选择性必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年活动单导学课程高中化学选择性必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第58页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
11. [2025 无锡江阴期中]铁及其化合物在生活中有广泛应用。
(1) Fe 在元素周期表中的位置是
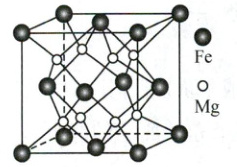
(2) 铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图所示。储氢时,$H_2$分子位于晶胞体心和棱的中心位置。该合金储满氢后所得晶体的化学式是
(3) $FeBr_2$为只含有离子键的离子化合物,其晶胞结构如图,距离一个$Fe^{2+}$最近的所有$Br^-$($Br^-$为顶点)构成的几何形状为
 ]
]
(1) Fe 在元素周期表中的位置是
第4周期Ⅷ族
,位于元素周期表的d
区。(2) 铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图所示。储氢时,$H_2$分子位于晶胞体心和棱的中心位置。该合金储满氢后所得晶体的化学式是
$\mathrm{Mg_2FeH_2}$
。
(3) $FeBr_2$为只含有离子键的离子化合物,其晶胞结构如图,距离一个$Fe^{2+}$最近的所有$Br^-$($Br^-$为顶点)构成的几何形状为
立方体(或正方体)
。 ]
]
答案:
11.
(1) 第4周期Ⅷ族 d
(2) $\mathrm{Mg_2FeH_2}$
(3) 立方体(或正方体)
解析:
(1) Fe是26号元素,位于元素周期表的第4周期Ⅷ族,在元素周期表中位于d区。
(2) 晶胞中,Mg个数为8,$\mathrm{N(Fe)=8× \frac{1}{8}+6× \frac{1}{2}=4}$,$\mathrm{N(H_2)=1+12× \frac{1}{4}=4}$,$\mathrm{N(Mg):N(Fe):N(H_2)=8:4:4=2:1:1}$,晶体的化学式为$\mathrm{Mg_2FeH_2}$。
(3) $\mathrm{FeBr_2}$中,$\mathrm{Fe^{2+}}$与$\mathrm{Br^-}$的比值为1:2,在晶胞中,大球个数为8,小球个数$\mathrm{=8× \frac{1}{8}+6× \frac{1}{2}=4}$,故小球为$\mathrm{Fe^{2+}}$,大球为$\mathrm{Br^-}$,由晶胞图可知,距一个$\mathrm{Fe^{2+}}$最近的$\mathrm{Br^-}$有8个,构成的几何形状为立方体(或正方体)。
(1) 第4周期Ⅷ族 d
(2) $\mathrm{Mg_2FeH_2}$
(3) 立方体(或正方体)
解析:
(1) Fe是26号元素,位于元素周期表的第4周期Ⅷ族,在元素周期表中位于d区。
(2) 晶胞中,Mg个数为8,$\mathrm{N(Fe)=8× \frac{1}{8}+6× \frac{1}{2}=4}$,$\mathrm{N(H_2)=1+12× \frac{1}{4}=4}$,$\mathrm{N(Mg):N(Fe):N(H_2)=8:4:4=2:1:1}$,晶体的化学式为$\mathrm{Mg_2FeH_2}$。
(3) $\mathrm{FeBr_2}$中,$\mathrm{Fe^{2+}}$与$\mathrm{Br^-}$的比值为1:2,在晶胞中,大球个数为8,小球个数$\mathrm{=8× \frac{1}{8}+6× \frac{1}{2}=4}$,故小球为$\mathrm{Fe^{2+}}$,大球为$\mathrm{Br^-}$,由晶胞图可知,距一个$\mathrm{Fe^{2+}}$最近的$\mathrm{Br^-}$有8个,构成的几何形状为立方体(或正方体)。
12. 根据表格数据回答下列有关问题。
(1) 已知$NaBr$、$NaCl$、$MgO$三种离子晶体的核间距和晶格能如下表所示。

①$NaBr$晶体的晶格能比$NaCl$
②$MgO$晶体的晶格能比$NaCl$大,主要原因是
③$NaBr$、$NaCl$和$MgO$晶体中,熔点最高的是
(2) Mg 是第 3 周期元素,该周期部分元素氟化物的熔点如下表所示。

解释表中氟化物熔点差异的原因:
①因为$NaF$与$MgF_2$为离子晶体,$SiF_4$为分子晶体(见本专题第四单元),所以$NaF$、$MgF_2$的熔点远比$SiF_4$高;
②
(1) 已知$NaBr$、$NaCl$、$MgO$三种离子晶体的核间距和晶格能如下表所示。

①$NaBr$晶体的晶格能比$NaCl$
小
(填“大”或“小”),主要原因是$\mathrm{NaBr}$晶体中离子的核间距比$\mathrm{NaCl}$大
。②$MgO$晶体的晶格能比$NaCl$大,主要原因是
$\mathrm{MgO}$晶体中阴、阳离子的电荷数多,并且离子的核间距小
。③$NaBr$、$NaCl$和$MgO$晶体中,熔点最高的是
$\mathrm{MgO}$
。(2) Mg 是第 3 周期元素,该周期部分元素氟化物的熔点如下表所示。

解释表中氟化物熔点差异的原因:
①因为$NaF$与$MgF_2$为离子晶体,$SiF_4$为分子晶体(见本专题第四单元),所以$NaF$、$MgF_2$的熔点远比$SiF_4$高;
②
因为$\mathrm{Mg^{2+}}$的半径比$\mathrm{Na^+}$小且$\mathrm{Mg^{2+}}$所带电荷数较多,$\mathrm{MgF_2}$的离子键强度比$\mathrm{NaF}$大,所以$\mathrm{MgF_2}$的熔点比$\mathrm{NaF}$高
。
答案:
12.
(1) ①小 $\mathrm{NaBr}$晶体中离子的核间距比$\mathrm{NaCl}$大 ②$\mathrm{MgO}$晶体中阴、阳离子的电荷数多,并且离子的核间距小 ③$\mathrm{MgO}$
(2) ②因为$\mathrm{Mg^{2+}}$的半径比$\mathrm{Na^+}$小且$\mathrm{Mg^{2+}}$所带电荷数较多,$\mathrm{MgF_2}$的离子键强度比$\mathrm{NaF}$大,所以$\mathrm{MgF_2}$的熔点比$\mathrm{NaF}$高
(1) ①小 $\mathrm{NaBr}$晶体中离子的核间距比$\mathrm{NaCl}$大 ②$\mathrm{MgO}$晶体中阴、阳离子的电荷数多,并且离子的核间距小 ③$\mathrm{MgO}$
(2) ②因为$\mathrm{Mg^{2+}}$的半径比$\mathrm{Na^+}$小且$\mathrm{Mg^{2+}}$所带电荷数较多,$\mathrm{MgF_2}$的离子键强度比$\mathrm{NaF}$大,所以$\mathrm{MgF_2}$的熔点比$\mathrm{NaF}$高
查看更多完整答案,请扫码查看


