2025年活动单导学课程高中化学选择性必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年活动单导学课程高中化学选择性必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第44页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
11. 根据信息进行推断并回答相关问题。
(1)$A$、$B$、$C$、$D$、$E$代表前4周期原子序数依次增大的五种元素。$A$、$D$同主族且有两种常见化合物${DA_{2}}$和${DA_{3}}$;工业上电解熔融${C_{2}A_{3}}$制取单质$C$;$B$、$E$除最外层均只有2个电子外,其余各层全充满,$E$位于元素周期表的$ds$区。$A$、$D$中电负性较大的是
(2)$A$、$B$、$C$、$D$为1~20号元素,$A$的$M$层上有2对成对电子,$B$的离子与$D$的离子具有相同的电子层结构,且可以相互组合形成干燥剂,$C$的单质为双原子分子,氢化物的水溶液呈碱性,$D$元素最高正价是$+7$。元素$A$的原子最外层共有
(3)现有前4周期的5种元素的部分信息如下表所示。

基态${T^{2+}}$的电子排布式:
(1)$A$、$B$、$C$、$D$、$E$代表前4周期原子序数依次增大的五种元素。$A$、$D$同主族且有两种常见化合物${DA_{2}}$和${DA_{3}}$;工业上电解熔融${C_{2}A_{3}}$制取单质$C$;$B$、$E$除最外层均只有2个电子外,其余各层全充满,$E$位于元素周期表的$ds$区。$A$、$D$中电负性较大的是
O
(填元素符号),基态$E$原子价电子排布式:3d¹⁰4s²
。(2)$A$、$B$、$C$、$D$为1~20号元素,$A$的$M$层上有2对成对电子,$B$的离子与$D$的离子具有相同的电子层结构,且可以相互组合形成干燥剂,$C$的单质为双原子分子,氢化物的水溶液呈碱性,$D$元素最高正价是$+7$。元素$A$的原子最外层共有
6
种不同运动状态的电子,有2
种能量不同的电子。$A$和$D$元素中,电负性较大的为Cl
(填元素符号)。(3)现有前4周期的5种元素的部分信息如下表所示。

基态${T^{2+}}$的电子排布式:
[Ar]3d⁶或1s²2s²2p⁶3s²3p⁶3d⁶
。$Y$、$Z$、$R$的电负性由大到小的顺序为O>N>Si
(用元素符号表示)。
答案:
(1)O 3d¹⁰4s² (2)6 2 Cl
(3)[Ar]3d⁶或1s²2s²2p⁶3s²3p⁶3d⁶ O>N>Si
解析:(1)A、B、C、D、E代表前4周期原子序数依次增大的五种元素,A、D同主族且有两种常见化合物DA₂和DA₃,则D为S,A为O;B、E除最外层均只有2个电子外,其余各层全充满,则B为Mg,E位于元素周期表的ds区,则E为Zn,工业上电解熔融C₂A₃制取单质C,则C为Al。(2)A、B、C、D分别为S、Ca、N、Cl元素,原子最外层上有几个电子就有几种不同的运动状态,同一能级上电子的能量相同,所以S原子最外层有6种不同运动状态的电子,这些电子占据3s和3p两个能级,故有两种不同能量的电子。(3)X的阴离子核外电子云均呈球形,所以X为H;Y原子的能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素中最大,Y为N;Z的基态原子核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和,Z为O;元素R原子的外围电子排布式为nsⁿ⁻¹npⁿ⁻¹,s轨道中最多能容纳2个电子,所以n等于3,R为Si;T元素的一种核素的质量数为65,中子数为36 ,T的质子数为29,T为Cu。
(3)[Ar]3d⁶或1s²2s²2p⁶3s²3p⁶3d⁶ O>N>Si
解析:(1)A、B、C、D、E代表前4周期原子序数依次增大的五种元素,A、D同主族且有两种常见化合物DA₂和DA₃,则D为S,A为O;B、E除最外层均只有2个电子外,其余各层全充满,则B为Mg,E位于元素周期表的ds区,则E为Zn,工业上电解熔融C₂A₃制取单质C,则C为Al。(2)A、B、C、D分别为S、Ca、N、Cl元素,原子最外层上有几个电子就有几种不同的运动状态,同一能级上电子的能量相同,所以S原子最外层有6种不同运动状态的电子,这些电子占据3s和3p两个能级,故有两种不同能量的电子。(3)X的阴离子核外电子云均呈球形,所以X为H;Y原子的能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素中最大,Y为N;Z的基态原子核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和,Z为O;元素R原子的外围电子排布式为nsⁿ⁻¹npⁿ⁻¹,s轨道中最多能容纳2个电子,所以n等于3,R为Si;T元素的一种核素的质量数为65,中子数为36 ,T的质子数为29,T为Cu。
12. [2025常州阶段练习]已知:元素的某种性质“$X$”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的$X$的数值:
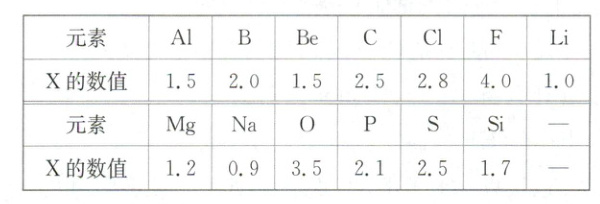
(1)经验规律告诉我们:当形成化学键的两原子相应元素的$X$差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断${BeCl_{2}}$中的化学键类型是
(2)根据上表给出的数据,简述主族元素$X$的数值大小与元素的金属性或非金属性强弱之间的关系:
(3)请你预测$Br$元素与$I$元素的$X$数值的大小关系:
(4)某有机化合物分子中含有$S—N$,你认为该共用电子对偏向于

(1)经验规律告诉我们:当形成化学键的两原子相应元素的$X$差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断${BeCl_{2}}$中的化学键类型是
共价键
。(2)根据上表给出的数据,简述主族元素$X$的数值大小与元素的金属性或非金属性强弱之间的关系:
元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强)
。(3)请你预测$Br$元素与$I$元素的$X$数值的大小关系:
Br>I
。(4)某有机化合物分子中含有$S—N$,你认为该共用电子对偏向于
N
(填元素符号)原子。
答案:
(1)共价键
(2)元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强)
(3)Br>I
(4)N
解析:(1)题给X为电负性,由表中数据可知,Be的电负性为1.5,Cl的电负性为2.8,两者电负性的差值为1.3,小于1.7,则BeCl₂中的化学键为共价键。(2)同周期主族元素从左到右,金属性依次减弱,非金属性依次增强,由表中数据可知,同周期主族元素从左到右,电负性依次增强,说明元素电负性的数值越大,元素的非金属性越强,元素电负性的数值越小,元素的金属性越强。(3)同主族元素从上到下,非金属性依次减弱,电负性依次减小,溴和碘都位于元素周期表ⅦA族,则溴元素的电负性大于碘元素。(4)由同周期元素的电负性递变规律可知,N元素的电负性应大于2.5而小于3.5,S元素的电负性为2.5,则N元素非金属性强于S元素,S—N中的共用电子对偏向于非金属性强的N原子一方。
专题3 微粒间作用力与物质性质
(2)元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强)
(3)Br>I
(4)N
解析:(1)题给X为电负性,由表中数据可知,Be的电负性为1.5,Cl的电负性为2.8,两者电负性的差值为1.3,小于1.7,则BeCl₂中的化学键为共价键。(2)同周期主族元素从左到右,金属性依次减弱,非金属性依次增强,由表中数据可知,同周期主族元素从左到右,电负性依次增强,说明元素电负性的数值越大,元素的非金属性越强,元素电负性的数值越小,元素的金属性越强。(3)同主族元素从上到下,非金属性依次减弱,电负性依次减小,溴和碘都位于元素周期表ⅦA族,则溴元素的电负性大于碘元素。(4)由同周期元素的电负性递变规律可知,N元素的电负性应大于2.5而小于3.5,S元素的电负性为2.5,则N元素非金属性强于S元素,S—N中的共用电子对偏向于非金属性强的N原子一方。
专题3 微粒间作用力与物质性质
查看更多完整答案,请扫码查看


