2025年活动单导学课程高中化学选择性必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年活动单导学课程高中化学选择性必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第71页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
8. [2024 泰州期中]解释下列物质性质的变化规律时,与共价键的键能无关的是 (
A.$N_2$比$P_4$的化学性质稳定
B.$F_2$、$Cl_2$、$Br_2$、$I_2$的沸点逐渐升高
C.金刚石的熔点比晶体硅高
D.$HF$、$HCl$、$HBr$、$HI$的热稳定性依次减弱
B
)A.$N_2$比$P_4$的化学性质稳定
B.$F_2$、$Cl_2$、$Br_2$、$I_2$的沸点逐渐升高
C.金刚石的熔点比晶体硅高
D.$HF$、$HCl$、$HBr$、$HI$的热稳定性依次减弱
答案:
8.B 发生化学反应时破坏共价键,键能越大,化学性质越稳定,A错误;沸点升高是因为相对分子质量增大,分子间作用力增大,和键能无关,B正确;金刚石和晶体硅属于共价晶体,熔化时破坏共价键,键长越短,键能越大,故和键能有关,C错误;热稳定性是指发生分解反应,需要破坏分子中的共价键,故和键能有关,D错误。
9. 已知某些化学键键能如下,下列说法不正确的是 (
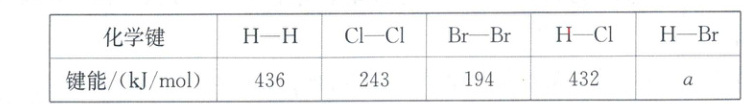
A.根据键能可估算反应$H_2(g) + Cl_2(g) \xlongequal{ } 2HCl(g)$的$\Delta H = -185 kJ/mol$
B.根据原子半径可知,键长:$H—Cl < H—Br$,进而推测$a < 432$
C.可以根据$H—Cl$和$H—Br$的键能大小判断$HCl$和$HBr$的热稳定性
D.常温下$Cl_2$和$Br_2$的状态不同,与$Cl—Cl$和$Br—Br$的键能有关
D
)
A.根据键能可估算反应$H_2(g) + Cl_2(g) \xlongequal{ } 2HCl(g)$的$\Delta H = -185 kJ/mol$
B.根据原子半径可知,键长:$H—Cl < H—Br$,进而推测$a < 432$
C.可以根据$H—Cl$和$H—Br$的键能大小判断$HCl$和$HBr$的热稳定性
D.常温下$Cl_2$和$Br_2$的状态不同,与$Cl—Cl$和$Br—Br$的键能有关
答案:
9.D 根据反应热=反应物总键能-生成物总键能,则H₂(g)+Cl₂(g)=2HCl(g)的ΔH=436kJ/mol+243kJ/mol-2×432kJ/mol=-185kJ/mol,A正确;Cl原子半径小于Br原子,则键长H—Cl<H—Br,键能H—Cl>H—Br,进而推测a<432,B正确;键能越大,物质的热稳定性越大,可以根据H—Cl和H—Br的键能大小判断HCl和HBr的稳定性,C正确;键能Cl—Cl>Br—Br,说明Cl₂分子比Br₂分子稳定,破坏的是共价键,而常温下Cl₂和Br₂的状态由分子间作用力决定,D错误。
10. [2024 苏州阶段练习]化学材料已经在人们的生活中扮演着不可替代的角色。比如:①镓、锗是重要的半导体材料。②新型碳化硅$(SiC)$增强铝基复合材料、碳纳米管(一种同轴管状结构的碳原子簇,是纳米级石墨晶体)、石墨炔都是近年来合成的新材料。
(1) 与镓同族的铝元素形成的化合物$AlF_3$具有较高的熔点$(1040^{\circ}C)$,而$AlCl_3$在$178^{\circ}C$时升华,原因是
(2)$CO_2$的电子式为
(3) 列举一个事实说明$C$和$Si$的非金属性强弱:
(4) 新型碳化硅增强铝基复合材料曾助力“天问一号”成功探火,它不具有的性质是
A. 耐高温
B. 密度大
C. 耐腐蚀
D. 抗磨损
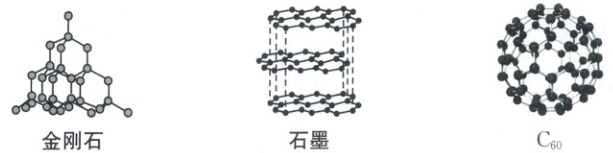
(5) 下图几种碳单质中,属于共价晶体的是
(1) 与镓同族的铝元素形成的化合物$AlF_3$具有较高的熔点$(1040^{\circ}C)$,而$AlCl_3$在$178^{\circ}C$时升华,原因是
F的电负性大于Cl,F、Al电负性差值比Cl、Al大,AlF₃是离子晶体,AlCl₃是分子晶体,离子晶体的熔、沸点高,不易升华
。(2)$CO_2$的电子式为
:O::C::O:
。(3) 列举一个事实说明$C$和$Si$的非金属性强弱:
H₂SiO₃的酸性比H₂CO₃弱,说明Si的非金属性比C弱
。(4) 新型碳化硅增强铝基复合材料曾助力“天问一号”成功探火,它不具有的性质是
B
(填字母)。A. 耐高温
B. 密度大
C. 耐腐蚀
D. 抗磨损
(5) 下图几种碳单质中,属于共价晶体的是
金刚石
,$C_{60}$晶体中构成物质的微粒间的作用力是范德华力或分子间作用力
。
答案:
10.
(1)F的电负性大于Cl,F、Al电负性差值比Cl、Al大,AlF₃是离子晶体,AlCl₃是分子晶体,离子晶体的熔、沸点高,不易升华
(2):O::C::O:
(3)H₂SiO₃的酸性比H₂CO₃弱,说明Si的非金属性比C弱
(4)B
解析:
(4)由碳化硅增强铝基复合材料(其组成可表示为SiC/Al)应用于“天问一号”航空领域知,该材料应该具备的特点有耐高温、耐腐蚀、抗磨损等,但由于从地球向太空发射时需克服地磁场强大的吸引作用,故其应该具有密度小、质量轻的特点,若材料的密度大,增大发射火箭的质量,发射时就需消耗更高的能量,无形增加发射难度,故选B。
(5)金刚石属于共价晶体,石墨属于混合型晶体,C₆₀属于分子晶体;C₆₀间的作用力是范德华力或分子间作用力。
(1)F的电负性大于Cl,F、Al电负性差值比Cl、Al大,AlF₃是离子晶体,AlCl₃是分子晶体,离子晶体的熔、沸点高,不易升华
(2):O::C::O:
(3)H₂SiO₃的酸性比H₂CO₃弱,说明Si的非金属性比C弱
(4)B
解析:
(4)由碳化硅增强铝基复合材料(其组成可表示为SiC/Al)应用于“天问一号”航空领域知,该材料应该具备的特点有耐高温、耐腐蚀、抗磨损等,但由于从地球向太空发射时需克服地磁场强大的吸引作用,故其应该具有密度小、质量轻的特点,若材料的密度大,增大发射火箭的质量,发射时就需消耗更高的能量,无形增加发射难度,故选B。
(5)金刚石属于共价晶体,石墨属于混合型晶体,C₆₀属于分子晶体;C₆₀间的作用力是范德华力或分子间作用力。
11. 金刚石和金刚砂$(SiC)$具有相似的晶体结构,在金刚砂的三维骨架结构中(如图所示),碳原子、硅原子交替以单键相结合。试回答下列问题。
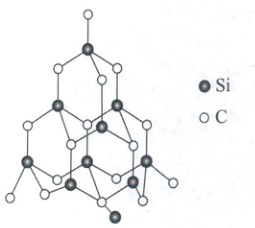
(1) 金刚砂属于
(2) 在金刚砂的结构中,一个硅原子周围结合
(3) 金刚砂的结构中含有由共价键形成的原子环,其中最小的环上有

(1) 金刚砂属于
共价
晶体。金刚砂熔点比金刚石熔点低
。(2) 在金刚砂的结构中,一个硅原子周围结合
4
个碳原子,键角是109°28′
。(3) 金刚砂的结构中含有由共价键形成的原子环,其中最小的环上有
3
个硅原子。
答案:
11.
(1)共价 低
(2)4 109°28′
(3)3
(1)共价 低
(2)4 109°28′
(3)3
查看更多完整答案,请扫码查看


