2025年活动单导学课程高中化学选择性必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年活动单导学课程高中化学选择性必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第29页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
活动二:了解常见的几种核外电子排布的表示方法
1. 用数字在能级符号右上角标明该能级上排布的电子数,就是电子排布式。如$ Al$原子电子排布式中各符号、数字的意义如下:
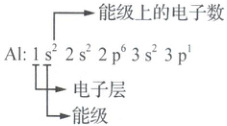
电子排布是遵循构造原理,从第三层开始各能级不完全遵循能层顺序,产生“能级交错现象”,构造原理中出现能级交错源于光谱实验的结果,但书写电子排布式时应按照电子层的顺序书写。如钾原子的最外层电子处于$4s$轨道而不是$3d$轨道,钾原子的电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{1}$或$[ Ar]4s^{1}$。
(1)写出下列原子的电子排布式:①$ S$:
(2)为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示,写出上述三种原子的简化电子排布式:①$ S$:
(3)在化学反应中,一般是原子的外围电子(对于主族元素的原子而言,外围电子就是最外层电子)发生变化。所以,描述原子核外电子排布时,也可以仅写出原子的外围电子排布式。

1~36 号元素的原子外围电子排布
1. 用数字在能级符号右上角标明该能级上排布的电子数,就是电子排布式。如$ Al$原子电子排布式中各符号、数字的意义如下:

电子排布是遵循构造原理,从第三层开始各能级不完全遵循能层顺序,产生“能级交错现象”,构造原理中出现能级交错源于光谱实验的结果,但书写电子排布式时应按照电子层的顺序书写。如钾原子的最外层电子处于$4s$轨道而不是$3d$轨道,钾原子的电子排布式为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{1}$或$[ Ar]4s^{1}$。
(1)写出下列原子的电子排布式:①$ S$:
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{4}$
;②$ Ca$:$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{2}$
;③$ Fe$:$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{6}4s^{2}$
。(2)为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示,写出上述三种原子的简化电子排布式:①$ S$:
$[Ne]3s^{2}3p^{4}$
;②$ Ca$:$[Ar]4s^{2}$
;③$ Fe$:$[Ar]3d^{6}4s^{2}$
。(3)在化学反应中,一般是原子的外围电子(对于主族元素的原子而言,外围电子就是最外层电子)发生变化。所以,描述原子核外电子排布时,也可以仅写出原子的外围电子排布式。

1~36 号元素的原子外围电子排布
答案:
1.
(1)①$1s^{2}2s^{2}2p^{6}3s^{2}3p^{4}$
②$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{2}$
③$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{6}4s^{2}$
(2)①$[Ne]3s^{2}3p^{4}$ ②$[Ar]4s^{2}$
③$[Ar]3d^{6}4s^{2}$
(1)①$1s^{2}2s^{2}2p^{6}3s^{2}3p^{4}$
②$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{2}$
③$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{6}4s^{2}$
(2)①$[Ne]3s^{2}3p^{4}$ ②$[Ar]4s^{2}$
③$[Ar]3d^{6}4s^{2}$
2. 将每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子称为轨道表示式。以铝原子为例,轨道表示式中各符号、数字的意义如下:

若无特别说明,电子排布式、轨道表示式反映的都是基态原子(即处于最低能量状态的原子)的电子排布情况。
(1)写出下列基态原子的轨道表示式:
①$ O$:
(2)根据洪特规则,在能量相同的原子轨道上,电子的排布将尽可能占据 。
。

若无特别说明,电子排布式、轨道表示式反映的都是基态原子(即处于最低能量状态的原子)的电子排布情况。
(1)写出下列基态原子的轨道表示式:
①$ O$:
$1s^{2}2s^{2}2p^{2}$
;②$ Na$:$1s^{2}2s^{2}2p^{6}3s^{1}$
。(2)根据洪特规则,在能量相同的原子轨道上,电子的排布将尽可能占据
不同
的轨道,而自旋状态相同
,所以碳原子的轨道表示式为
答案:
2.
(1)①$1s^{2}2s^{2}2p^{2}$
②$1s^{2}2s^{2}2p^{6}3s^{1}$
(2)不同 相同

2.
(1)①$1s^{2}2s^{2}2p^{2}$
②$1s^{2}2s^{2}2p^{6}3s^{1}$
(2)不同 相同

查看更多完整答案,请扫码查看


