5. (营口中考)下列有关溶液的说法,正确的是 ( )
A.溶质一定为固体
B.饱和溶液不能再溶解任何物质
C.溶液是均一、稳定的混合物
D.稀溶液一定是不饱和溶液
A.溶质一定为固体
B.饱和溶液不能再溶解任何物质
C.溶液是均一、稳定的混合物
D.稀溶液一定是不饱和溶液
答案:
C
易错提示
溶液概念辨析
在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如图所示:

C
易错提示
溶液概念辨析
在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如图所示:

6. (柳州中考)“油、盐、酱、醋、糖”是家庭中常见的厨房用品,其中与水充分混合后不能形成溶液的是 (
A.食用油
B.食盐
C.蔗糖
D.米醋
A
)A.食用油
B.食盐
C.蔗糖
D.米醋
答案:
A
7. (毕节中考)室温时,向 25 g 某固体物质中分批次加入水,充分搅拌,结果如图所示(温度保持不变)。室温时该物质的溶解度可能是 (
A.50 g
B.35 g
C.30 g
D.25 g
B
)A.50 g
B.35 g
C.30 g
D.25 g
答案:
B 解析:由图可知,当25g该固体物质中加入75g水时,固体物质完全溶解,假设此时恰好完全溶解,设该物质的溶解度为x,则$\frac{25\ \text{g}}{75\ \text{g}}=\frac{x}{100\ \text{g}}$,$x\approx33.3\ \text{g}$。由图可知,25g该固体物质在50g水中不能完全溶解,则该物质的溶解度小于50g,因此该物质的溶解度在33.3g与50g之间(不包括50g)。
8. (杭州中考)$ 40^{\circ}C $时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是 (
A.溶剂的质量
B.溶质的质量
C.溶液中溶质的质量分数
D.食盐的溶解度
D
)A.溶剂的质量
B.溶质的质量
C.溶液中溶质的质量分数
D.食盐的溶解度
答案:
D 解析:$40\ \celsius$时恒温蒸发一杯不饱和食盐水至有晶体析出,溶剂的质量逐渐减少,溶质的质量也减少,故选项A、B错误;$40\ \celsius$时恒温蒸发一杯不饱和食盐水至有晶体析出,溶液由不饱和溶液变为饱和溶液,溶质的质量分数变大,故选项C错误;温度不变,食盐的溶解度不变,故选项D正确。
方法点金
溶解度与溶质的质量分数
在一定温度下,某固体物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度,计算公式为溶解度$=\frac{\text{溶质质量}}{\text{溶剂质量}}×100\ \text{g}$(必须选取饱和溶液)。
溶液中溶质的质量分数是溶质质量与溶液质量之比,计算公式为溶质的质量分数$=\frac{\text{溶质质量}}{\text{溶液质量}}×100\%$。
方法点金
溶解度与溶质的质量分数
在一定温度下,某固体物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度,计算公式为溶解度$=\frac{\text{溶质质量}}{\text{溶剂质量}}×100\ \text{g}$(必须选取饱和溶液)。
溶液中溶质的质量分数是溶质质量与溶液质量之比,计算公式为溶质的质量分数$=\frac{\text{溶质质量}}{\text{溶液质量}}×100\%$。
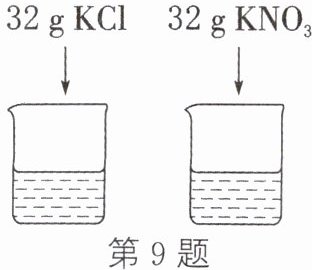
9. (益阳中考)如图所示,$ 20^{\circ}C $时,向两只盛有 100 g 水的烧杯中分别加入 32 g KCl 固体和 32 g $ KNO_3 $ 固体,充分溶解。根据实验数据并结合溶解度表回答下列问题:
|温度/℃|10|20|30|40|50|
|溶解度/g KCl|31.0|34.0|37.0|40.0|42.6|
|溶解度/g $ KNO_3 $|20.9|31.6|45.8|63.9|85.5|
(1) $ 20^{\circ}C $时,上述实验所形成的溶液为饱和溶液的是
(2) 将上述溶液分别加热至 $ 50^{\circ}C $(忽略实验过程中水的损失),则 KCl 溶液的溶质质量分数
|温度/℃|10|20|30|40|50|
|溶解度/g KCl|31.0|34.0|37.0|40.0|42.6|
|溶解度/g $ KNO_3 $|20.9|31.6|45.8|63.9|85.5|
(1) $ 20^{\circ}C $时,上述实验所形成的溶液为饱和溶液的是
$ KNO_3 $
(填“$ KNO_3 $”或“KCl”)溶液。(2) 将上述溶液分别加热至 $ 50^{\circ}C $(忽略实验过程中水的损失),则 KCl 溶液的溶质质量分数
=
(填“$ > $”“$ < $”或“$ = $”) $ KNO_3 $ 溶液的溶质质量分数。
答案:
(1)$\text{KNO}_3$ (2)= 解析:(1)$20\ \celsius$时,$\text{KCl}$和$\text{KNO}_3$的溶解度分别是34.0g、31.6g,$20\ \celsius$时,向两只盛有100g水的烧杯中,分别加入32g$\text{KCl}$固体和32g$\text{KNO}_3$固体,充分溶解,$\text{KNO}_3$不能全部溶解,形成的是饱和溶液,$\text{KCl}$固体能全部溶解,形成的是不饱和溶液。(2)$50\ \celsius$时,$\text{KCl}$和$\text{KNO}_3$的溶解度分别是42.6g、85.5g,将上述溶液分别加热至$50\ \celsius$,剩余的$\text{KNO}_3$固体能全部溶解,两种溶液中溶质的质量相等、溶剂的质量相等,则$\text{KCl}$溶液的溶质质量分数$=\text{KNO}_3$溶液的溶质质量分数。
10. (连云港中考)在实验室配制一定量溶质质量分数为 $ 6\% $ 的 NaCl 溶液。下列图示操作中,正确的是 ( )

答案:
C 解析:取用固体粉末状药品时,瓶塞要倒放,用药匙取用,不能用手接触药品,图中瓶塞没有倒放,故选项A错误;托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,且使用了游码,故选项B错误;量取液体读数时,视线应与液体的凹液面最低处保持水平,故选项C正确;配制$\text{NaCl}$溶液时,溶解操作应在烧杯中进行,不能在量筒内进行,故选项D错误。
方法点金
配制溶液
配制一定溶质质量分数的溶液的基本步骤包括计算、称量、量取、溶解,如图所示(以$\text{NaCl}$为例):

C 解析:取用固体粉末状药品时,瓶塞要倒放,用药匙取用,不能用手接触药品,图中瓶塞没有倒放,故选项A错误;托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,且使用了游码,故选项B错误;量取液体读数时,视线应与液体的凹液面最低处保持水平,故选项C正确;配制$\text{NaCl}$溶液时,溶解操作应在烧杯中进行,不能在量筒内进行,故选项D错误。
方法点金
配制溶液
配制一定溶质质量分数的溶液的基本步骤包括计算、称量、量取、溶解,如图所示(以$\text{NaCl}$为例):

11. (达州中考)在实验操作练习中,小明要配制 50 g 溶质质量分数为 $ 6\% $ 的 NaCl 溶液(已知 $ \rho_{水} = 1 g/cm^3 $),请回答下列问题:
(1) 小明应称取 NaCl 固体
A. 适量增加 NaCl
B. 适量减少 NaCl
C. 增加砝码
D. 调节天平平衡螺母
(2) 量取蒸馏水时,小明应选择
(3) 下列情况中,会造成小明所配溶液的溶质质量分数偏小的有
A. 量取蒸馏水时仰视读数
B. 量取蒸馏水时俯视读数
C. 将称量好的 NaCl 固体转移至烧杯时,NaCl 撒落
D. 配好的溶液转移到试剂瓶时,部分溶液溅出
(1) 小明应称取 NaCl 固体
3
g。在称量的过程中,发现托盘天平的指针向左偏转,此时小明应该B
(填字母)。A. 适量增加 NaCl
B. 适量减少 NaCl
C. 增加砝码
D. 调节天平平衡螺母
(2) 量取蒸馏水时,小明应选择
50 mL
(填“20 mL”“50 mL”或“100 mL”)的量筒。(3) 下列情况中,会造成小明所配溶液的溶质质量分数偏小的有
AC
(填字母)。A. 量取蒸馏水时仰视读数
B. 量取蒸馏水时俯视读数
C. 将称量好的 NaCl 固体转移至烧杯时,NaCl 撒落
D. 配好的溶液转移到试剂瓶时,部分溶液溅出
答案:
(1)3 B (2)50 mL (3)AC 解析:(1)溶质质量=溶液质量×溶质的质量分数,配制50g溶质质量分数为6%的$\text{NaCl}$溶液,需$\text{NaCl}$的质量$=50\ \text{g}×6\%=3\ \text{g}$。在称量的过程中,发现托盘天平的指针向左偏转,说明$\text{NaCl}$的质量大于需要的质量,应适量减少$\text{NaCl}$,直至天平平衡。(2)溶剂质量=溶液质量-溶质质量,所需溶剂的质量为$50\ \text{g}-3\ \text{g}=47\ \text{g}$(合47mL),应用规格为50mL的量筒取水。(3)量取蒸馏水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故A正确;量取蒸馏水时俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故B错误;将称量好的$\text{NaCl}$固体转移至烧杯时,$\text{NaCl}$撒落,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故C正确;配好的溶液转移到试剂瓶时,部分溶液溅出,溶液具有均一性,溶质质量分数不变,故D错误。
查看更多完整答案,请扫码查看


