19.(10分)(安徽中考)某兴趣小组利用如图所示的装置制备$CO_2,$并模拟自然界中$CO_2$的循环。请回答下列问题:

(1)装置B中仪器①的名称是______
(2)实验室用稀盐酸和石灰石制取$CO_2,$反应的化学方程式为______
(3)为制得$CO_2$的水溶液$,CO_2$应从装置C的______
(4)将$CO_2$的水溶液转移至烧杯,并组装装置D,置于阳光下一段时间,观察到有气泡产生,检验该气体的方法是______

(1)装置B中仪器①的名称是______
试管
。(2)实验室用稀盐酸和石灰石制取$CO_2,$反应的化学方程式为______
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
,发生装置是______A
(填字母)。(3)为制得$CO_2$的水溶液$,CO_2$应从装置C的______
m
(填“m”或“n”)端通入。(4)将$CO_2$的水溶液转移至烧杯,并组装装置D,置于阳光下一段时间,观察到有气泡产生,检验该气体的方法是______
将带火星的木条伸入收集到的气体中,观察木条是否复燃
。
答案:
(1)试管 (2)CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ A (3)m (4)将带火星的木条伸入收集到的气体中,观察木条是否复燃
20. 某科学兴趣小组欲测定一瓶过氧化氢溶液中溶质的质量分数,实验操作及相关数据如图所示(假设过氧化氢完全分解,不考虑氧气中带出的水分)。请计算:
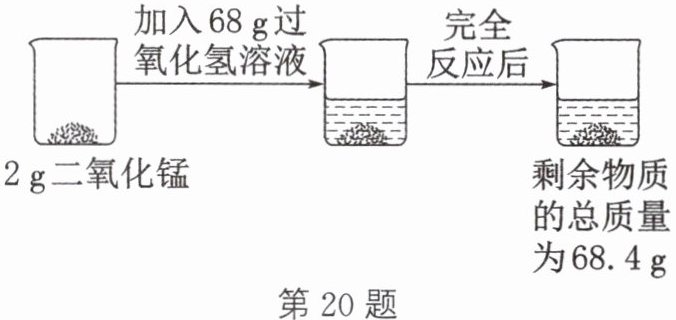
(1)反应后的剩余物质中二氧化锰的质量为
(2)这瓶过氧化氢溶液中溶质的质量分数。(写出计算过程)
(2)设参加反应的过氧化氢的质量为x。
2H₂O₂${\xlongequal{\text{MnO}_2}}$2H₂O+ O₂↑
68 32
x 1.6 g
$\frac{68}{32}$=$\frac{x}{1.6\ \text{g}}$ x=3.4 g
所以这瓶过氧化氢溶液中溶质的质量分数为$\frac{3.4\ \text{g}}{68\ \text{g}}$×100%=5%

(1)反应后的剩余物质中二氧化锰的质量为
2
g,生成氧气的质量为1.6
g。(2)这瓶过氧化氢溶液中溶质的质量分数。(写出计算过程)
(2)设参加反应的过氧化氢的质量为x。
2H₂O₂${\xlongequal{\text{MnO}_2}}$2H₂O+ O₂↑
68 32
x 1.6 g
$\frac{68}{32}$=$\frac{x}{1.6\ \text{g}}$ x=3.4 g
所以这瓶过氧化氢溶液中溶质的质量分数为$\frac{3.4\ \text{g}}{68\ \text{g}}$×100%=5%
答案:
(1)2 1.6 (2)设参加反应的过氧化氢的质量为x。
2H₂O₂${\xlongequal{\text{MnO}_2}}$2H₂O+ O₂↑
68 32
x 1.6 g
$\frac{68}{32}$=$\frac{x}{1.6\ \text{g}}$ x=3.4 g
所以这瓶过氧化氢溶液中溶质的质量分数为$\frac{3.4\ \text{g}}{68\ \text{g}}$×100%=5%
2H₂O₂${\xlongequal{\text{MnO}_2}}$2H₂O+ O₂↑
68 32
x 1.6 g
$\frac{68}{32}$=$\frac{x}{1.6\ \text{g}}$ x=3.4 g
所以这瓶过氧化氢溶液中溶质的质量分数为$\frac{3.4\ \text{g}}{68\ \text{g}}$×100%=5%
查看更多完整答案,请扫码查看


