22.(6分)某兴趣小组的同学对“双氧水分解产生氧气的速率与哪些因素有关”这一问题展开探究。实验设计如表所示。
|实验次序|双氧水的质量|双氧水的浓度|?|
|Ⅰ|50.0g|1%| |
|Ⅱ|50.0g|2%| |
|Ⅲ|50.0g|4%| |
(1)上述表格中,“?”处应填的内容是
(2)根据表格的设计,该实验探究的问题是
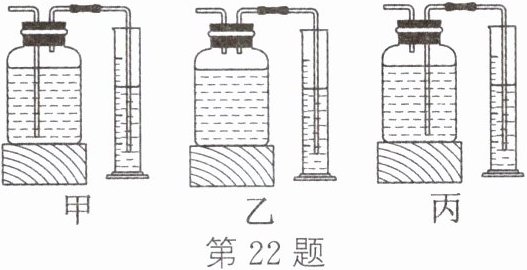
(3)本实验中测量产生氧气体积的装置如图
|实验次序|双氧水的质量|双氧水的浓度|?|
|Ⅰ|50.0g|1%| |
|Ⅱ|50.0g|2%| |
|Ⅲ|50.0g|4%| |
(1)上述表格中,“?”处应填的内容是
相同时间内产生氧气的体积(或收集相同体积的氧气所用的时间)
。(2)根据表格的设计,该实验探究的问题是
双氧水分解产生氧气的速率是否与双氧水的浓度有关
。(3)本实验中测量产生氧气体积的装置如图
丙
所示。
答案:
(1)相同时间内产生氧气的体积(或收集相同体积的氧气所用的时间) (2)双氧水分解产生氧气的速率是否与双氧水的浓度有关 (3)丙
23.(6分)(宿迁中考)如图甲所示为“探究感应电流产生条件”的实验装置示意图。

(1)磁体和导体棒AB相对静止,闭合开关,能否观察到灵敏电流计指针发生偏转的现象?______
(2)探究感应电流方向与导体切割磁感线方向的关系时,应该保持______
(3)小明猜想磁场强弱会影响感应电流大小,于是他设计了如图乙所示的电磁铁代替原有磁体再次实验,此时需要在图乙的电路中再接入的元件是______

(1)磁体和导体棒AB相对静止,闭合开关,能否观察到灵敏电流计指针发生偏转的现象?______
否
______。(2)探究感应电流方向与导体切割磁感线方向的关系时,应该保持______
磁场
______的方向不变。(3)小明猜想磁场强弱会影响感应电流大小,于是他设计了如图乙所示的电磁铁代替原有磁体再次实验,此时需要在图乙的电路中再接入的元件是______
滑动变阻器
______。
答案:
(1)否 (2)磁场 (3)滑动变阻器
24.(7分)某传统中药由连翘、金银花、甘草等多味药材组成。
(1)甘草素是甘草中的主要成分,其化学式为$C_1_5H_1_2O_4,$该分子中碳、氢、氧的原子个数比是
(2)从该中药中提取某有机化合物X,取一定量X与足量氧气完全反应,生成44g二氧化碳和9g水,则X中碳、氢元素的质量比为
(1)甘草素是甘草中的主要成分,其化学式为$C_1_5H_1_2O_4,$该分子中碳、氢、氧的原子个数比是
15:12:4
。(2)从该中药中提取某有机化合物X,取一定量X与足量氧气完全反应,生成44g二氧化碳和9g水,则X中碳、氢元素的质量比为
12:1
。
答案:
(1)$15:12:4$ (2)$12:1$ 解析:
(2)二氧化碳中的碳元素和水中的氢元素都来自X,则X中碳、氢元素的质量比为$[44\ \text{g}×(\frac{12}{44}×1\ 9\ \text{g}×(\frac{2}{18}×100\%)]=12:1$。
(2)二氧化碳中的碳元素和水中的氢元素都来自X,则X中碳、氢元素的质量比为$[44\ \text{g}×(\frac{12}{44}×1\ 9\ \text{g}×(\frac{2}{18}×100\%)]=12:1$。
25.(10分)某校学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取当地矿区石灰石样品20g,把80g稀盐酸分四次加入,测量过程中所得数据如表所示。(已知石灰石样品中含有的二氧化硅等杂质不溶于水,且不与稀盐酸反应)
|实验次序|加入稀盐酸的质量/g|剩余固体的质量/g|
|1|20|15|
|2|20|10|
|3|20|6.6|
|4|20|n|
(1)写出石灰石和稀盐酸反应的化学方程式:
(2)n的值是
(3)求样品中碳酸钙的质量分数。
(4)求稀盐酸中溶质的质量分数。
设与5 g碳酸钙反应的氯化氢的质量为x。
${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$
100 73
5 g x
$\frac{100}{73}=\frac{5\ \text{g}}{x}$
$x = 3.65\ \text{g}$
所以稀盐酸中溶质的质量分数为$\frac{3.65\ \text{g}}{20\ \text{g}}×100\% = 18.25\%$。
|实验次序|加入稀盐酸的质量/g|剩余固体的质量/g|
|1|20|15|
|2|20|10|
|3|20|6.6|
|4|20|n|
(1)写出石灰石和稀盐酸反应的化学方程式:
${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$
。(2)n的值是
6.6
。(3)求样品中碳酸钙的质量分数。
样品中碳酸钙的质量分数为$\frac{20\ \text{g}-6.6\ \text{g}}{20\ \text{g}}×100\% = 67\%$。
(4)求稀盐酸中溶质的质量分数。
设与5 g碳酸钙反应的氯化氢的质量为x。
${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$
100 73
5 g x
$\frac{100}{73}=\frac{5\ \text{g}}{x}$
$x = 3.65\ \text{g}$
所以稀盐酸中溶质的质量分数为$\frac{3.65\ \text{g}}{20\ \text{g}}×100\% = 18.25\%$。
答案:
(1)${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$ (2)6.6 (3)67% (4)18.25% 解析:(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$。(2)第1、2次加入20 g的稀盐酸后固体质量都减小了5 g,但是第3次加入20 g稀盐酸后固体质量只减小了3.4 g,说明第3次加入20 g的稀盐酸后,碳酸钙已完全反应,所以n的值是6.6。(3)样品中碳酸钙的质量分数为$\frac{20\ \text{g}-6.6\ \text{g}}{20\ \text{g}}×100\% = 67\%$。(4)设与5 g碳酸钙反应的氯化氢的质量为x。${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$100 735 g x$\frac{100}{73}=\frac{5\ \text{g}}{x}$ $x = 3.65\ \text{g}$所以稀盐酸中溶质的质量分数为$\frac{3.65\ \text{g}}{20\ \text{g}}×1\ 18.25\%$。
查看更多完整答案,请扫码查看


