第100页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
3. 小明同学准备用$24.5gKClO_{3}来制取O_{2}$,在加热时忘记加入催化剂。经查阅资料,$KClO_{3}$加热时先发生反应①$2KClO_{3}\xlongequal{\triangle}KClO_{4}+KCl+O_{2}\uparrow$,升高温度继续发生反应②$KClO_{4}\xlongequal{\triangle}KCl+2O_{2}\uparrow$。试计算:
(1)$KClO_{3}中K和O$的质量比为______
(2)当反应①中生成$O_{2}的质量为1.6g$时(假设反应②尚未进行),$KCl$在剩余固体中的质量分数是多少(结果精确到$0.1\%$)?
(1)$KClO_{3}中K和O$的质量比为______
39:48
;(2)当反应①中生成$O_{2}的质量为1.6g$时(假设反应②尚未进行),$KCl$在剩余固体中的质量分数是多少(结果精确到$0.1\%$)?
解:设生成KCl的质量为x。
2KClO₃$\xlongequal{\triangle}$KClO₄+KCl+O₂↑
74.5 32
x 1.6 g
$\frac{74.5}{32}=\frac{x}{1.6\;\text{g}}$ $x=3.725\;\text{g}$
KCl在剩余固体中的质量分数是$\frac{3.725\;\text{g}}{24.5\;\text{g}-1.6\;\text{g}}×100\%\approx16.3\%$
答:KCl在剩余固体中的质量分数约是16.3%。
2KClO₃$\xlongequal{\triangle}$KClO₄+KCl+O₂↑
74.5 32
x 1.6 g
$\frac{74.5}{32}=\frac{x}{1.6\;\text{g}}$ $x=3.725\;\text{g}$
KCl在剩余固体中的质量分数是$\frac{3.725\;\text{g}}{24.5\;\text{g}-1.6\;\text{g}}×100\%\approx16.3\%$
答:KCl在剩余固体中的质量分数约是16.3%。
答案:
(1)39:48
(2)解:设生成KCl的质量为x。
2KClO₃$\xlongequal{\triangle}$KClO₄+KCl+O₂↑
74.5 32
x 1.6 g
$\frac{74.5}{32}=\frac{x}{1.6\;\text{g}}$ $x=3.725\;\text{g}$
KCl在剩余固体中的质量分数是$\frac{3.725\;\text{g}}{24.5\;\text{g}-1.6\;\text{g}}×100\%\approx16.3\%$
答:KCl在剩余固体中的质量分数约是16.3%。
(1)39:48
(2)解:设生成KCl的质量为x。
2KClO₃$\xlongequal{\triangle}$KClO₄+KCl+O₂↑
74.5 32
x 1.6 g
$\frac{74.5}{32}=\frac{x}{1.6\;\text{g}}$ $x=3.725\;\text{g}$
KCl在剩余固体中的质量分数是$\frac{3.725\;\text{g}}{24.5\;\text{g}-1.6\;\text{g}}×100\%\approx16.3\%$
答:KCl在剩余固体中的质量分数约是16.3%。
4. 实验室有一包含杂质的氧化铁样品。为测定样品中氧化铁的质量分数,某小组完成了图1所示实验。实验过程中固体的质量随时间的变化关系如图2所示(杂质不发生反应。发生反应的化学方程式为$3H_{2}+Fe_{2}O_{3}\xlongequal{高温}2Fe+3H_{2}O$):
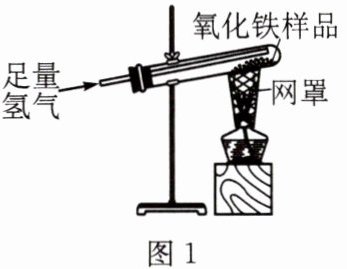

请回答下列问题:
(1)网罩的作用是______
(2)计算样品中氧化铁的质量分数(写出计算过程,计算结果保留到$0.1\%$)。
解:设样品中Fe₂O₃的质量为x。
3H₂+Fe₂O₃$\frac{\underline{\;高温\;}}{}$2Fe+3H₂O 固体减少
160 112 48
x 18.0 g-13.2 g
$\frac{160}{48}=\frac{x}{18.0\;\text{g}-13.2\;\text{g}}$ $x=16\;\text{g}$
样品中氧化铁的质量分数为$\frac{16\;\text{g}}{18\;\text{g}}×100\%\approx88.9\%$
答:样品中Fe₂O₃的质量分数约为88.9%。


请回答下列问题:
(1)网罩的作用是______
使火焰集中,提高温度
;(2)计算样品中氧化铁的质量分数(写出计算过程,计算结果保留到$0.1\%$)。
解:设样品中Fe₂O₃的质量为x。
3H₂+Fe₂O₃$\frac{\underline{\;高温\;}}{}$2Fe+3H₂O 固体减少
160 112 48
x 18.0 g-13.2 g
$\frac{160}{48}=\frac{x}{18.0\;\text{g}-13.2\;\text{g}}$ $x=16\;\text{g}$
样品中氧化铁的质量分数为$\frac{16\;\text{g}}{18\;\text{g}}×100\%\approx88.9\%$
答:样品中Fe₂O₃的质量分数约为88.9%。
答案:
(1)使火焰集中,提高温度
(2)解:设样品中Fe₂O₃的质量为x。
3H₂+Fe₂O₃$\frac{\underline{\;高温\;}}{}$2Fe+3H₂O 固体减少
160 112 48
x 18.0 g-13.2 g
$\frac{160}{48}=\frac{x}{18.0\;\text{g}-13.2\;\text{g}}$ $x=16\;\text{g}$
样品中氧化铁的质量分数为$\frac{16\;\text{g}}{18\;\text{g}}×100\%\approx88.9\%$
答:样品中Fe₂O₃的质量分数约为88.9%。
(1)使火焰集中,提高温度
(2)解:设样品中Fe₂O₃的质量为x。
3H₂+Fe₂O₃$\frac{\underline{\;高温\;}}{}$2Fe+3H₂O 固体减少
160 112 48
x 18.0 g-13.2 g
$\frac{160}{48}=\frac{x}{18.0\;\text{g}-13.2\;\text{g}}$ $x=16\;\text{g}$
样品中氧化铁的质量分数为$\frac{16\;\text{g}}{18\;\text{g}}×100\%\approx88.9\%$
答:样品中Fe₂O₃的质量分数约为88.9%。
查看更多完整答案,请扫码查看


