14 某白色粉末可能由碳酸钠、氯化钠、氢氧化钠、氯化钡中的一种或几种组成,为确定其组成,某同学进行如下实验。实验一:取适量该固体加入水中,得到浑浊液体,过滤;实验二:取实验一所得滤液少许于试管中,加入过量氯化钡溶液,振荡,静置后滴加酚酞溶液,溶液变红。下列判断正确的是 ( )
A. 该白色粉末中不含氯化钡
B. 该白色粉末中含有氢氧化钠
C. 该白色粉末中一定没有氯化钠
D. 实验二中将氯化钡溶液改成氢氧化钡溶液对实验无影响
A. 该白色粉末中不含氯化钡
B. 该白色粉末中含有氢氧化钠
C. 该白色粉末中一定没有氯化钠
D. 实验二中将氯化钡溶液改成氢氧化钡溶液对实验无影响
答案:
B
15 现有一包固体,可能含有氯化钠、碳酸钙、硝酸钡、硫酸钠、氢氧化钠中的一种或几种。为确定该固体成分,小明取少量固体于烧杯中,加入足量水并不断搅拌,固体部分溶解;然后向烧杯中逐滴加入稀硝酸至过量,烧杯中固体的质量随加入稀硝酸质量的变化情况如图所示。下列说法正确的是 ( )

A. BC 段溶液 pH 逐渐增大
B. B 点对应溶液中一定含有的溶质是硝酸钙、硝酸钠、氯化钠
C. C 点对应溶液中一定含有的阳离子是 H⁺、Na⁺、Ca²⁺
D. 原固体中一定含有硫酸钠、碳酸钙、氯化钠

A. BC 段溶液 pH 逐渐增大
B. B 点对应溶液中一定含有的溶质是硝酸钙、硝酸钠、氯化钠
C. C 点对应溶液中一定含有的阳离子是 H⁺、Na⁺、Ca²⁺
D. 原固体中一定含有硫酸钠、碳酸钙、氯化钠
答案:
C
16 有一白色固体 X,其主要成分是氯化钠,可能含有氯化钙、硫酸铜、氢氧化钙中的一种或几种。为探究其组成进行如下实验,主要流程及现象记录如下:
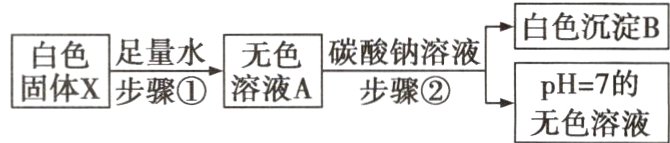
【查阅资料】氯化钙溶液呈中性。
回答下列问题:
(1)根据步骤①实验现象确定白色固体 X 中一定没有的物质是 。
(2)步骤②中产生白色沉淀 B 的化学方程式是 。
(3)白色固体 X 中的物质有 。
(4)将白色固体 X 转化成氯化钠固体的实验方案是 。

【查阅资料】氯化钙溶液呈中性。
回答下列问题:
(1)根据步骤①实验现象确定白色固体 X 中一定没有的物质是 。
(2)步骤②中产生白色沉淀 B 的化学方程式是 。
(3)白色固体 X 中的物质有 。
(4)将白色固体 X 转化成氯化钠固体的实验方案是 。
答案:
(1)硫酸铜
(2)CaCl₂ + Na₂CO₃ = CaCO₃↓ + 2NaCl
(3)氯化钠和氯化钙
(4)取白色固体X于烧杯中,加水溶解,加入适量Na₂CO₃溶液,过滤,蒸发滤液,当有较多固体出现时,停止加热,冷却后得到氯化钠固体
(1)硫酸铜
(2)CaCl₂ + Na₂CO₃ = CaCO₃↓ + 2NaCl
(3)氯化钠和氯化钙
(4)取白色固体X于烧杯中,加水溶解,加入适量Na₂CO₃溶液,过滤,蒸发滤液,当有较多固体出现时,停止加热,冷却后得到氯化钠固体
17 (邵阳中考)除去下列物质中所含的少量杂质(括号内为杂质),所用试剂和方法正确的是 ( )
A. O₂(N₂):通过灼热的铜网
B. CO₂(CO):通入氧气后点燃
C. FeSO₄ 溶液(CuSO₄):加入过量的铁粉,过滤
D. NaCl 溶液(Na₂SO₄):加入过量的 BaCl₂ 溶液,过滤
A. O₂(N₂):通过灼热的铜网
B. CO₂(CO):通入氧气后点燃
C. FeSO₄ 溶液(CuSO₄):加入过量的铁粉,过滤
D. NaCl 溶液(Na₂SO₄):加入过量的 BaCl₂ 溶液,过滤
答案:
C [解析]A项,氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,会把原物质除去;B项,除去二氧化碳中的一氧化碳不能通氧气点燃,会引入新的气体杂质且CO₂大量存在的情况下,CO不能被点燃;C项,过量的铁粉能与硫酸铜反应生成硫酸亚铁和铜,经过过滤,能除去杂质且没有引入新的杂质;D项,Na₂SO₄溶液能与过量的BaCl₂溶液反应生成硫酸钡沉淀和氯化钠,能除去杂质但引入了新的杂质,不符合除杂原则。
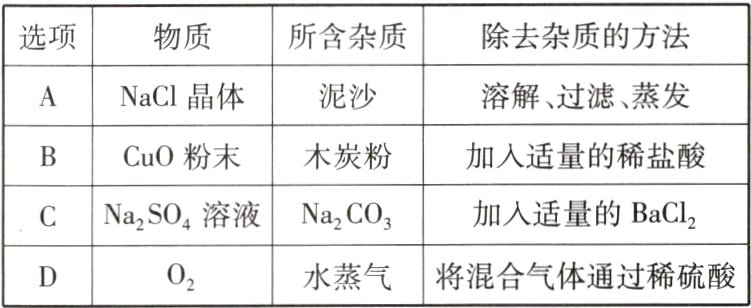
18 (衡阳中考)下列除杂方法正确的是 ( )

答案:
A [解析]氯化钠易溶于水,泥沙不溶于水,溶解、过滤、蒸发,能够除去泥沙得到氯化钠晶体,A正确;木炭粉和稀盐酸不反应,氧化铜会与稀盐酸反应,不能除去杂质,反而会把原物质除去,B错误;Na₂SO₄和Na₂CO₃都能和BaCl₂反应,除去杂质的同时也会把原物质除去,且引入新杂质NaCl,C错误;稀硫酸不具有吸水性,混合气体通过稀硫酸不能除去水蒸气,D错误。
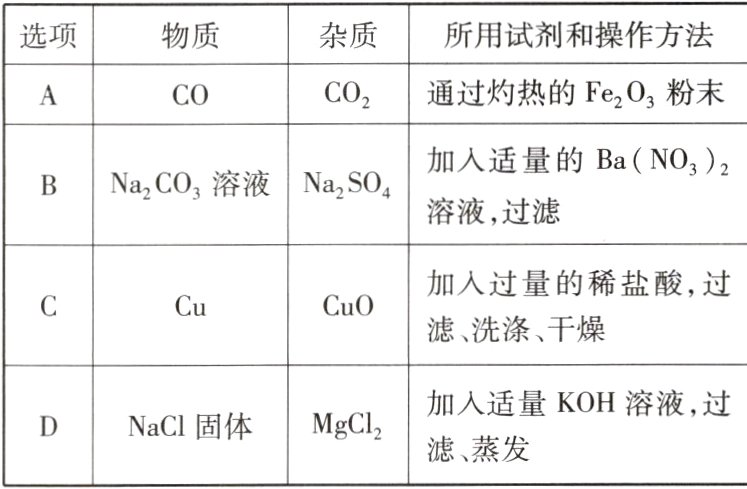
19 (泰安中考)除去下列物质中混有的少量杂质,所用试剂和操作方法均正确的是 ( )

答案:
C
20 (陕西宝鸡陈仓一模)海水晒盐可得粗盐,粗盐中除含 NaCl 外,还含有泥沙、CaCl₂、MgCl₂、Na₂SO₄ 等杂质,利用海水生产 NaCl 的流程图如下所示:
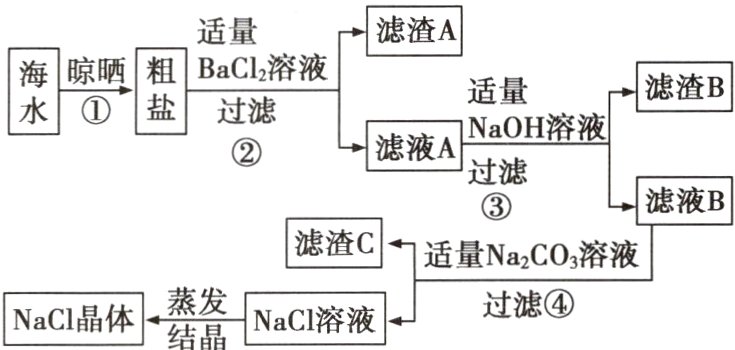
(1)加入适量 BaCl₂ 溶液是为了除去 Na₂SO₄,请写出该反应的化学方程式: 。
(2)向滤液 A 中加适量 NaOH 的目的是 ,滤渣 C 是 (写化学式)。
(3)实验第①步进行晾晒,晾晒的目的是 。

(1)加入适量 BaCl₂ 溶液是为了除去 Na₂SO₄,请写出该反应的化学方程式: 。
(2)向滤液 A 中加适量 NaOH 的目的是 ,滤渣 C 是 (写化学式)。
(3)实验第①步进行晾晒,晾晒的目的是 。
答案:
(1)Na₂SO₄ + BaCl₂ = BaSO₄↓ + 2NaCl
(2)除去MgCl₂ CaCO₃
(3)蒸发掉海水中的水分
[解析]
(1)氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠。
(2)步骤②中得到的滤液中含有氯化镁,氯化镁可以和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,故向滤液A中加适量NaOH的目的是除去MgCl₂;向滤液B中加入适量的碳酸钠溶液,碳酸钠可以和氯化钙反应生成碳酸钙沉淀和氯化钠,因此滤渣C是CaCO₃。
(1)Na₂SO₄ + BaCl₂ = BaSO₄↓ + 2NaCl
(2)除去MgCl₂ CaCO₃
(3)蒸发掉海水中的水分
[解析]
(1)氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠。
(2)步骤②中得到的滤液中含有氯化镁,氯化镁可以和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,故向滤液A中加适量NaOH的目的是除去MgCl₂;向滤液B中加入适量的碳酸钠溶液,碳酸钠可以和氯化钙反应生成碳酸钙沉淀和氯化钠,因此滤渣C是CaCO₃。
查看更多完整答案,请扫码查看


