7. (成都中考)根据图示实验和溶解度表,下列说法正确的是 ( )

A. 若a是NaCl,则③中的溶液是不饱和溶液
B. 若a是NaCl,则④中溶质的质量分数约为27.2%
C. 若a是KNO₃,则③到④溶液由不饱和转化为饱和
D. 实验证明溶液是否饱和与温度、溶质的量和溶剂种类有关

A. 若a是NaCl,则③中的溶液是不饱和溶液
B. 若a是NaCl,则④中溶质的质量分数约为27.2%
C. 若a是KNO₃,则③到④溶液由不饱和转化为饱和
D. 实验证明溶液是否饱和与温度、溶质的量和溶剂种类有关
答案:
B [解析]60℃时氯化钠的溶解度为37.3g,即100g水中最多能溶解37.3g氯化钠,③中水的质量为20g,则最多能溶解氯化钠的质量为$20g\times(\frac{37.3g}{100g}\times100\%) = 7.46g$,a的质量为10g,a不能完全溶解,则③中的溶液是饱和溶液,A错误;若a是氯化钠,③中的溶液是饱和溶液,④中溶剂的质量减小,则④中溶液仍为饱和溶液,其溶质质量分数为$\frac{37.3g}{37.3g + 100g}\times100\%\approx27.2\%$,B正确;60℃时硝酸钾的溶解度为110g,若a是KNO₃,③中水的质量为20g,则最多能溶解硝酸钾的质量为$20g\times(\frac{110g}{100g}\times100\%) = 22g$,则③中溶液为硝酸钾的不饱和溶液,④中水的质量为15g,最多能溶解硝酸钾的质量为$15g\times(\frac{110g}{100g}\times100\%) = 16.5g$,则④中硝酸钾溶液仍然属于不饱和溶液,C错误;实验能证明溶液是否饱和与温度、溶质的量有关,由于实验中所涉及溶剂只有水,不能证明溶液是否饱和与溶剂种类有关,D错误。
8. (陕西渭南期末)根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题。
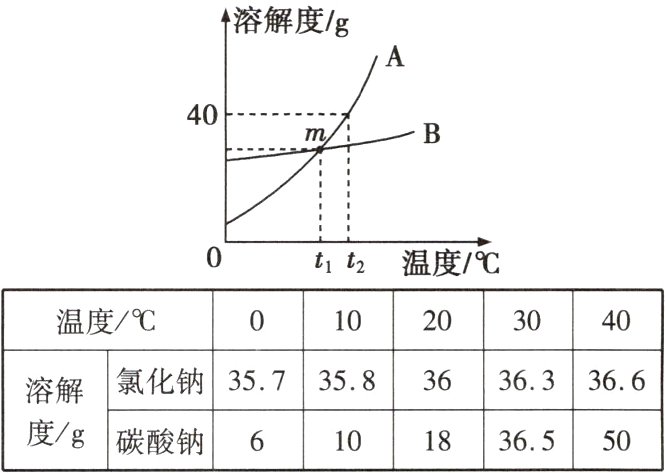
(1)图中表示Na₂CO₃溶解度曲线的是______(填“A”或“B”),10℃时将3.5 g NaCl加入10 g水中充分溶解,得到的是______(填“饱和”或“不饱和”)溶液。
(2)m点表示的意义是____________________。
(3)t₂℃时将40 g固体A加入50 g水中,充分搅拌后,所得溶液的质量为______。
(4)若Na₂CO₃中混有少量的NaCl,提纯Na₂CO₃应采取的方法是____________(填“降温结晶”或“蒸发结晶”)。

(1)图中表示Na₂CO₃溶解度曲线的是______(填“A”或“B”),10℃时将3.5 g NaCl加入10 g水中充分溶解,得到的是______(填“饱和”或“不饱和”)溶液。
(2)m点表示的意义是____________________。
(3)t₂℃时将40 g固体A加入50 g水中,充分搅拌后,所得溶液的质量为______。
(4)若Na₂CO₃中混有少量的NaCl,提纯Na₂CO₃应采取的方法是____________(填“降温结晶”或“蒸发结晶”)。
答案:
(1)A 不饱和
(2)t₁℃时,Na₂CO₃和NaCl的溶解度相等
(3)70g
(4)降温结晶
[解析]
(1)表示Na₂CO₃溶解度曲线的是A,因为碳酸钠的溶解度受温度的影响变化较大,10℃时将3.5gNaCl加入10g水中充分溶解,得到的是不饱和溶液,因为该温度下氯化钠的溶解度是35.8g即10℃,100g水中最多溶解35.8gNaCl,10g水中最多溶解3.58gNaCl。
(2)m点表示t₁℃时,Na₂CO₃和NaCl的溶解度相等。
(3)t₂℃时,A的溶解度是40g,因此将40g固体A加入50g水中,最多溶解20g,所得溶液的质量为50g+20g=70g。
(4)若Na₂CO₃中混有少量的NaCl,提纯Na₂CO₃应采取的方法是降温结晶,因为碳酸钠的溶解度随温度的变化程度比氯化钠大。
(1)A 不饱和
(2)t₁℃时,Na₂CO₃和NaCl的溶解度相等
(3)70g
(4)降温结晶
[解析]
(1)表示Na₂CO₃溶解度曲线的是A,因为碳酸钠的溶解度受温度的影响变化较大,10℃时将3.5gNaCl加入10g水中充分溶解,得到的是不饱和溶液,因为该温度下氯化钠的溶解度是35.8g即10℃,100g水中最多溶解35.8gNaCl,10g水中最多溶解3.58gNaCl。
(2)m点表示t₁℃时,Na₂CO₃和NaCl的溶解度相等。
(3)t₂℃时,A的溶解度是40g,因此将40g固体A加入50g水中,最多溶解20g,所得溶液的质量为50g+20g=70g。
(4)若Na₂CO₃中混有少量的NaCl,提纯Na₂CO₃应采取的方法是降温结晶,因为碳酸钠的溶解度随温度的变化程度比氯化钠大。
9. (安徽合肥庐江县月考)我国化学家侯德榜创立的“侯氏制碱法”促进了世界制碱技术的发展,其主要生产流程如图1所示。NH₄Cl和NaCl的溶解度曲线如图2所示。

(1)操作a的名称是______,图1流程中可循环利用的一种物质是______(除水外)。
(2)NaCl与NH₄Cl相比,______的溶解度受温度的影响较大。
(3)20℃时,将72 g NH₄Cl溶于水制成饱和溶液,需加入水的质量是______g;将20℃时NaCl的饱和溶液降温到t℃,该过程没有改变的是______(填字母)。
A. 溶液质量 B. 溶质质量 C. 溶剂质量 D. 溶质的溶解度

(1)操作a的名称是______,图1流程中可循环利用的一种物质是______(除水外)。
(2)NaCl与NH₄Cl相比,______的溶解度受温度的影响较大。
(3)20℃时,将72 g NH₄Cl溶于水制成饱和溶液,需加入水的质量是______g;将20℃时NaCl的饱和溶液降温到t℃,该过程没有改变的是______(填字母)。
A. 溶液质量 B. 溶质质量 C. 溶剂质量 D. 溶质的溶解度
答案:
(1)过滤 二氧化碳(或CO₂)
(2)氯化铵(或NH₄Cl)
(3)200 C
[解析]
(1)操作a可以将固体从溶液中分离出来,是过滤操作,二氧化碳既是反应物也是生成物,所以题图1流程中可循环利用的物质是二氧化碳。
(2)通过分析溶解度曲线可知,氯化钠与氯化铵相比,氯化铵的溶解度受温度的影响较大。
(3)20℃时,NH₄Cl的溶解度是36g,所以将72g氯化铵溶于水制成饱和溶液,需加入水的质量是200g;将20℃时氯化钠的饱和溶液降温到t℃,溶解度减小,有晶体析出,溶质、溶液的质量减少,该过程没有改变的是溶剂的质量。
(1)过滤 二氧化碳(或CO₂)
(2)氯化铵(或NH₄Cl)
(3)200 C
[解析]
(1)操作a可以将固体从溶液中分离出来,是过滤操作,二氧化碳既是反应物也是生成物,所以题图1流程中可循环利用的物质是二氧化碳。
(2)通过分析溶解度曲线可知,氯化钠与氯化铵相比,氯化铵的溶解度受温度的影响较大。
(3)20℃时,NH₄Cl的溶解度是36g,所以将72g氯化铵溶于水制成饱和溶液,需加入水的质量是200g;将20℃时氯化钠的饱和溶液降温到t℃,溶解度减小,有晶体析出,溶质、溶液的质量减少,该过程没有改变的是溶剂的质量。
10. (十堰中考)甲、乙两种固体(均不含结晶水)的溶解度曲线如图2所示,请回答下列问题:

(1)t₃℃时,乙的溶解度是______g。
(2)t₃℃时,甲形成的饱和溶液中溶质与溶液的质量比为______。
(3)t₁℃时,把等质量的甲、乙两种物质分别放入两只烧杯中,加入100 g水,充分搅拌,溶解情况如图1所示,则B烧杯内溶质是______(填“甲”或“乙”)。现对图1中两烧杯内物质同时做如下处理,有关说法正确的是______。
A. 升温至t₂℃,均形成不饱和溶液
B. 升温至t₂℃,所得溶液中溶质的质量分数相同
C. 先升温至t₃℃,再通过恒温蒸发溶剂的方法使两溶液均刚好达到饱和,蒸发水的质量:烧杯A>烧杯B

(1)t₃℃时,乙的溶解度是______g。
(2)t₃℃时,甲形成的饱和溶液中溶质与溶液的质量比为______。
(3)t₁℃时,把等质量的甲、乙两种物质分别放入两只烧杯中,加入100 g水,充分搅拌,溶解情况如图1所示,则B烧杯内溶质是______(填“甲”或“乙”)。现对图1中两烧杯内物质同时做如下处理,有关说法正确的是______。
A. 升温至t₂℃,均形成不饱和溶液
B. 升温至t₂℃,所得溶液中溶质的质量分数相同
C. 先升温至t₃℃,再通过恒温蒸发溶剂的方法使两溶液均刚好达到饱和,蒸发水的质量:烧杯A>烧杯B
答案:
(1)20
(2)1:3
(3)甲 AB
[解析]
(2)t₃℃时,甲的溶解度是50g,即100g水中溶解50g甲达到饱和,其中溶质与溶液的质量比为50g:(50g+100g)=1:3。
(3)t₁℃时,甲的溶解度小于乙的溶解度,把等质量的甲、乙两种物质分别放入两只烧杯中,加入100g水,充分搅拌,B烧杯中有未溶解的物质,则B烧杯内溶质是甲。t₁℃时,A烧杯中溶质全部溶解,B烧杯中溶质有剩余,说明加入溶质的质量大于t₁℃时甲的溶解度,小于或等于t₁℃时乙的溶解度。升温至t₂℃,甲、乙的溶解度均增大,且甲剩余溶质可以全部溶解,二者均形成不饱和溶液,因所加溶质、溶剂的质量相等,则所得溶液的溶质质量分数相等,A、B正确;t₃℃时甲的溶解度大于乙的溶解度,则溶解等质量的甲、乙需要水的质量:甲<乙,故蒸发水的质量:烧杯A<烧杯B,C错误。
(1)20
(2)1:3
(3)甲 AB
[解析]
(2)t₃℃时,甲的溶解度是50g,即100g水中溶解50g甲达到饱和,其中溶质与溶液的质量比为50g:(50g+100g)=1:3。
(3)t₁℃时,甲的溶解度小于乙的溶解度,把等质量的甲、乙两种物质分别放入两只烧杯中,加入100g水,充分搅拌,B烧杯中有未溶解的物质,则B烧杯内溶质是甲。t₁℃时,A烧杯中溶质全部溶解,B烧杯中溶质有剩余,说明加入溶质的质量大于t₁℃时甲的溶解度,小于或等于t₁℃时乙的溶解度。升温至t₂℃,甲、乙的溶解度均增大,且甲剩余溶质可以全部溶解,二者均形成不饱和溶液,因所加溶质、溶剂的质量相等,则所得溶液的溶质质量分数相等,A、B正确;t₃℃时甲的溶解度大于乙的溶解度,则溶解等质量的甲、乙需要水的质量:甲<乙,故蒸发水的质量:烧杯A<烧杯B,C错误。
查看更多完整答案,请扫码查看


