1 (济宁中考)某溶液中大量存在着四种离子。对这四种离子的判断,正确的是 ( )
A. K⁺、Ca²⁺、SO₄²⁻、NO₃⁻
B. H⁺、Ca²⁺、Cl⁻、OH⁻
C. Fe³⁺、Na⁺、OH⁻、SO₄²⁻
D. H⁺、Ag⁺、CO₃²⁻、NO₃⁻
A. K⁺、Ca²⁺、SO₄²⁻、NO₃⁻
B. H⁺、Ca²⁺、Cl⁻、OH⁻
C. Fe³⁺、Na⁺、OH⁻、SO₄²⁻
D. H⁺、Ag⁺、CO₃²⁻、NO₃⁻
答案:
A
2 (北部湾中考)下列各组离子在 pH = 1 的无色溶液中,能大量共存的是 ( )
A. K⁺、Mg²⁺、Fe²⁺、SO₄²⁻
B. K⁺、Ag⁺、NO₃⁻、Cl⁻
C. Ca²⁺、NH₄⁺、NO₃⁻、Cl⁻
D. Na⁺、OH⁻、SO₄²⁻、CO₃²⁻
A. K⁺、Mg²⁺、Fe²⁺、SO₄²⁻
B. K⁺、Ag⁺、NO₃⁻、Cl⁻
C. Ca²⁺、NH₄⁺、NO₃⁻、Cl⁻
D. Na⁺、OH⁻、SO₄²⁻、CO₃²⁻
答案:
C [解析]彼此不会结合生成沉淀、气体或水的离子可在溶液中大量共存。本题隐含的条件:①pH = 1的溶液显酸性,含有大量H⁺;②溶液无色,不含Cu²⁺、Fe²⁺、Fe³⁺、MnO₄⁻等。含有Fe²⁺的溶液显浅绿色,A错误;Ag⁺与Cl⁻能结合生成氯化银沉淀,B错误;Ca²⁺、NH₄⁺、NO₃⁻、Cl⁻彼此不会结合生成沉淀、气体或水,且在酸性溶液中能大量共存,C正确;酸性溶液中含有H⁺,OH⁻与H⁺能结合生成水,CO₃²⁻与H⁺能结合生成水和二氧化碳,D错误。
3 (常德中考)下列各组物质在水中能大量共存且溶液无色透明的是 ( )
A. NaOH、KNO₃、MgCl₂
B. Na₂CO₃、HCl、BaCl₂
C. KNO₃、NaCl、H₂SO₄
D. FeCl₃、KCl、HCl
A. NaOH、KNO₃、MgCl₂
B. Na₂CO₃、HCl、BaCl₂
C. KNO₃、NaCl、H₂SO₄
D. FeCl₃、KCl、HCl
答案:
C [解析]A项,NaOH、MgCl₂反应生成氢氧化镁沉淀和氯化钠,不能大量共存,故A选项错误;B项,Na₂CO₃与HCl反应生成氯化钠、水和二氧化碳,Na₂CO₃与BaCl₂反应生成碳酸钡沉淀和氯化钠,不能大量共存,故B选项错误;C项,三者之间不反应,能大量共存,且不存在有色离子,故C选项正确;D项,三者之间不反应,能大量共存,但含FeCl₃的溶液呈黄色,故D选项错误。
4 (株洲中考)下列选项中各溶质的溶液混合,无明显现象的是 ( )
A. NaCl、BaCl₂、KNO₃
B. CuSO₄、NaOH、KCl
C. BaCl₂、Na₂SO₄、HCl
D. CaCl₂、Na₂CO₃、KNO₃
A. NaCl、BaCl₂、KNO₃
B. CuSO₄、NaOH、KCl
C. BaCl₂、Na₂SO₄、HCl
D. CaCl₂、Na₂CO₃、KNO₃
答案:
A
5 (怀化中考)下列各组物质在同一溶液中能大量共存,且形成无色溶液的是 ( )
A. NaCl、BaCl₂、HCl
B. CuCl₂、KCl、H₂SO₄
C. Ca(NO₃)₂、Na₂CO₃、KOH
D. HCl、NaOH、Na₂SO₄
A. NaCl、BaCl₂、HCl
B. CuCl₂、KCl、H₂SO₄
C. Ca(NO₃)₂、Na₂CO₃、KOH
D. HCl、NaOH、Na₂SO₄
答案:
A
6 (仙桃中考)下列各组离子,在指定的溶液中能大量共存的是 ( )
A. pH = 3 的溶液中:NH₄⁺、Mg²⁺、SO₄²⁻、CO₃²⁻
B. pH = 11 的溶液中:Na⁺、K⁺、Cl⁻、CO₃²⁻
C. 无色溶液中:Cu²⁺、Al³⁺、Cl⁻、NO₃⁻
D. 含有大量 SO₄²⁻的溶液中:Ba²⁺、H⁺、Cl⁻、HCO₃⁻
A. pH = 3 的溶液中:NH₄⁺、Mg²⁺、SO₄²⁻、CO₃²⁻
B. pH = 11 的溶液中:Na⁺、K⁺、Cl⁻、CO₃²⁻
C. 无色溶液中:Cu²⁺、Al³⁺、Cl⁻、NO₃⁻
D. 含有大量 SO₄²⁻的溶液中:Ba²⁺、H⁺、Cl⁻、HCO₃⁻
答案:
B
7 甲、乙两相邻化工厂排放的污水中含有 Ag⁺、Ba²⁺、Fe³⁺、Na⁺、Cl⁻、SO₄²⁻、NO₃⁻、OH⁻八种离子中各不相同的四种离子,若单独排放会污染环境,如将甲、乙两厂的污水按适当比例充分混合,经沉降后排放出的污水转为无色澄清的硝酸钠溶液,污染程度大大降低。已知,甲工厂污水的 pH = 11,则该厂排放的污水中含有的四种离子是 ( )
A. Na⁺、Cl⁻、SO₄²⁻、OH⁻
B. Na⁺、Cl⁻、OH⁻、NO₃⁻
C. Na⁺、Cl⁻、Ba²⁺、OH⁻
D. Cl⁻、SO₄²⁻、NO₃⁻、OH⁻
A. Na⁺、Cl⁻、SO₄²⁻、OH⁻
B. Na⁺、Cl⁻、OH⁻、NO₃⁻
C. Na⁺、Cl⁻、Ba²⁺、OH⁻
D. Cl⁻、SO₄²⁻、NO₃⁻、OH⁻
答案:
A
8 (河南中考改编)下列根据某些性质区分一些常见物质的方法错误的是 ( )
A. 氢氧化钠和硝酸铵:加水溶解
B. 食盐水和稀盐酸:加无色酚酞溶液
C. 铜片和黄铜片:相互刻画
D. 氧气和二氧化碳:伸入燃着的木条
A. 氢氧化钠和硝酸铵:加水溶解
B. 食盐水和稀盐酸:加无色酚酞溶液
C. 铜片和黄铜片:相互刻画
D. 氧气和二氧化碳:伸入燃着的木条
答案:
B [解析]氢氧化钠溶于水放热,溶液温度升高,硝酸铵溶于水吸热,溶液温度降低,现象不同,可以区分,A正确;食盐水显中性,稀盐酸显酸性,都不能使无色酚酞溶液变色,现象相同,不能区分,B错误;黄铜片和铜片相互刻画,黄铜硬度较大,所以有明显划痕的是铜片,而无明显划痕的是黄铜片,现象不同,可以区分,C正确;氧气具有助燃性,能使燃着的木条燃烧得更旺,二氧化碳能使燃着的木条熄灭,现象不同,可以区分,D正确。
9 (长沙中考)下列鉴别物质的方法正确的是 ( )
A. 用水鉴别 NaCl、NaOH、NH₄NO₃ 三种固体
B. 用燃着的木条鉴别 O₂、CO₂、N₂ 三种气体
C. 用 Ba(OH)₂ 溶液鉴别 KCl、K₂SO₄、KNO₃ 三种溶液
D. 用 CO₂ 鉴别 NaOH、KOH、Ca(OH)₂ 三种溶液
A. 用水鉴别 NaCl、NaOH、NH₄NO₃ 三种固体
B. 用燃着的木条鉴别 O₂、CO₂、N₂ 三种气体
C. 用 Ba(OH)₂ 溶液鉴别 KCl、K₂SO₄、KNO₃ 三种溶液
D. 用 CO₂ 鉴别 NaOH、KOH、Ca(OH)₂ 三种溶液
答案:
A
10 (天津中考)下列实验方案不能达到实验目的的是 ( )


答案:
C [解析]A项,分别滴加足量稀盐酸,能产生气泡的是碳酸钾溶液,无明显现象的是氢氧化钾溶液;B项,分别加入少量二氧化锰粉末,能产生气泡的是5%的过氧化氢溶液,无明显现象的是水;C项,硫酸钠和碳酸钠两种溶液都能与氯化钡溶液反应,生成白色沉淀,不能鉴别;D项,将气体分别通入澄清石灰水中,能使澄清石灰水变浑浊的是二氧化碳,无明显现象的是氮气。
11 (济宁中考)下列四组物质的溶液,使用一种试剂仅通过一次反应就能将它们鉴别开来的是 ( )
A. HCl、NaOH、Na₂CO₃
B. NaCl、Na₂CO₃、NaNO₃
C. NaCl、BaCl₂、K₂CO₃
D. NaOH、KOH、Ca(NO₃)₂
A. HCl、NaOH、Na₂CO₃
B. NaCl、Na₂CO₃、NaNO₃
C. NaCl、BaCl₂、K₂CO₃
D. NaOH、KOH、Ca(NO₃)₂
答案:
C [解析]稀硫酸与氯化钠溶液混合没有明显现象,与氯化钡溶液混合产生白色沉淀,与碳酸钾溶液混合产生气泡,故使用稀硫酸一种试剂通过一次反应可以鉴别,C正确。
12 (益阳中考)下列物质的溶液,不另加其他试剂就能相互鉴别出来的一组是 ( )
A. H₂SO₄ NaOH CuSO₄
B. HCl Ca(OH)₂ NaCl
C. Na₂CO₃ CaCl₂ BaCl₂
D. KNO₃ Na₂SO₄ FeCl₃
A. H₂SO₄ NaOH CuSO₄
B. HCl Ca(OH)₂ NaCl
C. Na₂CO₃ CaCl₂ BaCl₂
D. KNO₃ Na₂SO₄ FeCl₃
答案:
A
13 已知溶液 X 可能为稀盐酸、稀硫酸或硫酸钠溶液三者之一。为判断其成分,取三份等量的该溶液,分别加入 BaCl₂ 溶液、CuO 固体、NaOH 溶液中,产生的现象如图所示。下列对该溶液的判断不正确的是 ( )
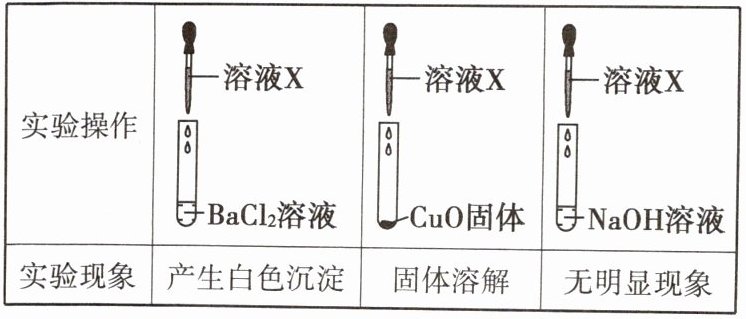
A. 溶液 X 能够使紫色石蕊溶液变红
B. 溶液 X 为硫酸钠溶液
C. 溶液 X 能与 NaOH 溶液发生反应
D. 溶液 X 为稀硫酸

A. 溶液 X 能够使紫色石蕊溶液变红
B. 溶液 X 为硫酸钠溶液
C. 溶液 X 能与 NaOH 溶液发生反应
D. 溶液 X 为稀硫酸
答案:
B
查看更多完整答案,请扫码查看


