1. 下列关于金属与氧气反应的说法正确的是( )
A. 金属与氧气反应都必须点燃或加热
B. “真金不怕火炼”说明金的熔点非常高
C. 镁只有在高温时才能与空气中的氧气反应
D. 根据金属与氧气反应的难易程度,可以初步比较一些金属的活动性
A. 金属与氧气反应都必须点燃或加热
B. “真金不怕火炼”说明金的熔点非常高
C. 镁只有在高温时才能与空气中的氧气反应
D. 根据金属与氧气反应的难易程度,可以初步比较一些金属的活动性
答案:
D [解析]金属与氧气反应不一定要点燃或加热,如铝在常温下能与氧气反应;“真金不怕火炼”说明金的化学性质稳定;镁在常温下能与空气中的氧气反应;根据金属与氧气反应的难易程度,可以初步比较一些金属的活动性。
2. 下列物质在一定条件下能与氧气反应,且生成物为黑色固体的一组是( )
①Mg ②Al ③Fe ④Au ⑤Cu
A. ①和③ B. 只有③ C. ③④⑤ D. ③和⑤
①Mg ②Al ③Fe ④Au ⑤Cu
A. ①和③ B. 只有③ C. ③④⑤ D. ③和⑤
答案:
D [解析]题中所给五种物质中仅有金不与氧气发生反应,而能与氧气发生反应的其余四种物质中只有铁和铜与氧气反应可得到黑色固体。
3. 将少量的生铁粉末加入足量稀硫酸中,下列叙述正确的是( )
①有气泡冒出 ②液体变为浅绿色
③粉末全部消失 ④液体质量减少
⑤留有少量黑色残渣
A. ①②③ B. ①②④ C. ①②⑤ D. ①④⑤
①有气泡冒出 ②液体变为浅绿色
③粉末全部消失 ④液体质量减少
⑤留有少量黑色残渣
A. ①②③ B. ①②④ C. ①②⑤ D. ①④⑤
答案:
C
4. 金属与盐酸反应的漫画如图所示。下列说法正确的是( )

A. 实验室可用铜和稀盐酸反应制氢气
B. 四种金属中反应最剧烈的是镁
C. 锌与稀盐酸反应过程中吸收热量
D. 铁与稀盐酸反应的化学方程式为2Fe + 6HCl = 2FeCl₃ + 3H₂↑

A. 实验室可用铜和稀盐酸反应制氢气
B. 四种金属中反应最剧烈的是镁
C. 锌与稀盐酸反应过程中吸收热量
D. 铁与稀盐酸反应的化学方程式为2Fe + 6HCl = 2FeCl₃ + 3H₂↑
答案:
B
5. (湘西州中考)下列化学反应中不属于置换反应的是( )
A. Zn + H₂SO₄ = ZnSO₄ + H₂↑
B. CO + CuO $\stackrel{\triangle}{=}$ Cu + CO₂
C. Cl₂ + 2NaI = 2NaCl + I₂
D. Fe + CuSO₄ = FeSO₄ + Cu
A. Zn + H₂SO₄ = ZnSO₄ + H₂↑
B. CO + CuO $\stackrel{\triangle}{=}$ Cu + CO₂
C. Cl₂ + 2NaI = 2NaCl + I₂
D. Fe + CuSO₄ = FeSO₄ + Cu
答案:
B [解析]此题应紧扣置换反应的特点“一换一”进行判断,即反应物为一种单质和一种化合物,生成物为另一种单质和另一种化合物。
6. 如图是四个化学反应的微观示意图,图中不同的球代表不同的原子,其中能表示置换反应的是( )

A.
B.
C.


A.
B.
C.

答案:
B [解析]观察化学反应的微观示意图可知,在B所示的反应中,反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,符合置换反应的特点,属于置换反应。
1. (徐州中考)在化学实验中要特别注意观察和记录实验现象。下列实验现象的记录正确的是( )
A. 铁在氧气中剧烈燃烧,放出大量热,生成黑色的四氧化三铁
B. 镁条在空气中燃烧生成黑色固体
C. 铁与稀盐酸充分反应后得到浅绿色溶液
D. 铜片加入稀硫酸中有大量气泡出现
A. 铁在氧气中剧烈燃烧,放出大量热,生成黑色的四氧化三铁
B. 镁条在空气中燃烧生成黑色固体
C. 铁与稀盐酸充分反应后得到浅绿色溶液
D. 铜片加入稀硫酸中有大量气泡出现
答案:
C [解析]铁在氧气中剧烈燃烧,放出大量热,生成黑色固体,生成四氧化三铁是实验结论而不是实验现象,故A错误;镁条在空气中燃烧生成白色固体,故B错误;铁与稀盐酸充分反应后得到浅绿色的氯化亚铁溶液,故C正确;铜片加入稀硫酸中不反应,无明显现象,故D错误。
2. 探究锌、铜、镁的金属活动性时,下列现象、分析或结论正确的是( )
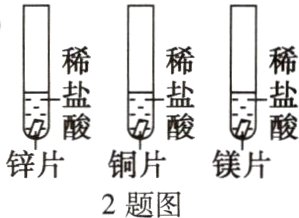
A. 稀盐酸的浓度可以不同
B. 铜片表面有气泡
C. 盛镁片的试管表面发烫
D. 金属活动性:Cu > Zn > Mg

A. 稀盐酸的浓度可以不同
B. 铜片表面有气泡
C. 盛镁片的试管表面发烫
D. 金属活动性:Cu > Zn > Mg
答案:
C
3. 在质量相等、浓度相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图所示。下列表述正确的是( )
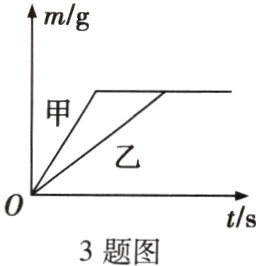
A. 甲表示金属铁
B. 反应结束后消耗两种金属的质量相等
C. 反应结束后稀硫酸都没有剩余
D. 反应结束后溶液都是无色的

A. 甲表示金属铁
B. 反应结束后消耗两种金属的质量相等
C. 反应结束后稀硫酸都没有剩余
D. 反应结束后溶液都是无色的
答案:
C [解析]由曲线可以看出,甲的反应速率更快,说明甲的活动性更强,故为金属锌;反应结束后生成氢气的质量相等,说明硫酸均反应完,且铁的相对原子质量小于锌,故反应结束时铁消耗的质量较小,即消耗两种金属的质量不相等;反应结束后形成的硫酸亚铁溶液是浅绿色的。
4. (河南中考)某金属混合物由Mg、Al、Zn、Cu四种金属中的两种组成。6.5 g该金属混合物与足量的盐酸反应,可得到0.2 g氢气,则该金属混合物中一定不含有的金属是( )
A. Mg B. Al C. Zn D. Cu
A. Mg B. Al C. Zn D. Cu
答案:
C [解析]因为金属铜不与盐酸反应,分别列出Mg、Al、Zn与盐酸反应的化学方程式,根据质量关系可知,生成0.2g氢气消耗Mg、Al、Zn的质量分别为2.4g、1.8g、6.5g。金属混合物样品由四种金属中的两种组成,由于6.5g锌与足量的盐酸反应生成氢气的质量为0.2g,与镁、铝中的一种混合,生成氢气的质量会大于0.2g;与铜混合,生成氢气的质量会小于0.2g,则此金属混合物中一定不含有的金属是锌。该金属混合物可能由Mg、Al中的一种和铜组成。
查看更多完整答案,请扫码查看


