5(陕西西安月考)同学们对金属N的活动性进行探究发现:将金属N放入稀盐酸中,有气泡产生(生成NCl₂),将金属N放入ZnSO₄溶液中无明显变化。下列化学方程式书写错误的是( )
A. N + H₂SO₄ === NSO₄ + H₂↑
B. N + MgSO₄ === Mg + NSO₄
C. 2Al + 3NSO₄ === 3N + Al₂(SO₄)₃
D. N + CuSO₄ === Cu + NSO₄
A. N + H₂SO₄ === NSO₄ + H₂↑
B. N + MgSO₄ === Mg + NSO₄
C. 2Al + 3NSO₄ === 3N + Al₂(SO₄)₃
D. N + CuSO₄ === Cu + NSO₄
答案:
B [解析]将金属N放入稀盐酸中,观察到有气泡产生(生成NCl₂),说明N能与稀盐酸反应,活动性:N > H,N在化合物中的化合价为 + 2;将金属N放入ZnSO₄溶液中无明显变化,说明Zn的金属活动性比N强,即金属活动性:Zn > N。由于活动性:N > H,所以N能与H₂SO₄反应,化学方程式为N + H₂SO₄ = NSO₄ + H₂↑,故A正确;由于金属活动性:Mg > Zn > N,所以N不能与MgSO₄反应,故B错误;由于金属活动性:Al > Zn > N,所以Al能与NSO₄反应,化学方程式为2Al + 3NSO₄ = 3N + Al₂(SO₄)₃,故C正确;由于活动性:N > H > Cu,所以N能与CuSO₄反应,化学方程式为N + CuSO₄ = NSO₄ + Cu,故D正确。
归纳总结
在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢;位于前面的金属能把排在它后面的金属从其化合物溶液中置换出来,据此可判断物质间能否发生反应、化学方程式是否正确等。
归纳总结
在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢;位于前面的金属能把排在它后面的金属从其化合物溶液中置换出来,据此可判断物质间能否发生反应、化学方程式是否正确等。
6[易错题]要验证铜、银、铁三种金属的活动性顺序,不能选用哪组物质进行实验( )
A. 银、铜、硝酸亚铁 B. 铜、铁、稀硫酸、硝酸银
C. 银、铁、硫酸铜 D. 铜、硝酸亚铁、硝酸银
A. 银、铜、硝酸亚铁 B. 铜、铁、稀硫酸、硝酸银
C. 银、铁、硫酸铜 D. 铜、硝酸亚铁、硝酸银
答案:
A [解析]根据金属活动性顺序可知,铜、银、铁三种金属的活动性顺序是铁 > 铜 > 银,在金属活动性顺序中,位于前面的金属能把排在它后面的金属从其化合物溶液中置换出来。银和铜都不能和硝酸亚铁反应,故不能验证银和铜的金属活动性顺序,A项符合题意;铜不与稀硫酸反应,铁能与稀硫酸反应,证明铁的活动性比铜强,铜能置换出硝酸银溶液中的银,证明铜的活动性比银强,能验证三种金属的活动性顺序,B项不符合题意;铁能和硫酸铜反应,证明铁的活动性比铜强,银和硫酸铜不反应,证明铜的活动性比银强,能验证三种金属的活动性顺序,C项不符合题意;铜和硝酸亚铁不反应,证明铁的活动性比铜强,铜和硝酸银能反应,证明铜的活动性比银强,能验证三种金属的活动性顺序,D项不符合题意。
易错分析
验证三种金属的活动性顺序,在设计实验方案时,以活动性位于中间的金属为中心,采取两边金属和中间金属化合物溶液,或两边金属化合物溶液和中间金属的简捷实验方案,也可通过金属与酸的反应进行逐一验证。
易错分析
验证三种金属的活动性顺序,在设计实验方案时,以活动性位于中间的金属为中心,采取两边金属和中间金属化合物溶液,或两边金属化合物溶液和中间金属的简捷实验方案,也可通过金属与酸的反应进行逐一验证。
7(北京中考)用下图所示实验研究金属的性质。

(1)①中有气体生成,生成的气体为________。
(2)③中反应的化学方程式为______________。
(3)下列实验组合中,能得出铁、铜、银的金属活动性顺序的是________(填序号)。
A. ①④ B. ③④ C. ①②④

(1)①中有气体生成,生成的气体为________。
(2)③中反应的化学方程式为______________。
(3)下列实验组合中,能得出铁、铜、银的金属活动性顺序的是________(填序号)。
A. ①④ B. ③④ C. ①②④
答案:
(1)氢气(或H₂)
(2)Fe + CuSO₄ = FeSO₄ + Cu
(3)BC
[解析]
(1)铁和稀硫酸反应生成硫酸亚铁和氢气,①中生成的气体为氢气(或H₂)。
(2)铁和硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为Fe + CuSO₄ = FeSO₄ + Cu。
(3)实验①说明金属活动性Fe > H,实验②说明金属活动性H > Cu,实验③说明金属活动性Fe > Cu,实验④说明金属活动性Cu > Ag。①④证明活动性Fe > H,Cu > Ag,没有比较Fe和Cu的金属活动性,A错误;③④证明金属活动性Fe > Cu,Cu > Ag,故金属活动性Fe > Cu > Ag,B正确;①②④证明金属活动性Fe > H,H > Cu,Cu > Ag,故金属活动性Fe > Cu > Ag,C正确。
(1)氢气(或H₂)
(2)Fe + CuSO₄ = FeSO₄ + Cu
(3)BC
[解析]
(1)铁和稀硫酸反应生成硫酸亚铁和氢气,①中生成的气体为氢气(或H₂)。
(2)铁和硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为Fe + CuSO₄ = FeSO₄ + Cu。
(3)实验①说明金属活动性Fe > H,实验②说明金属活动性H > Cu,实验③说明金属活动性Fe > Cu,实验④说明金属活动性Cu > Ag。①④证明活动性Fe > H,Cu > Ag,没有比较Fe和Cu的金属活动性,A错误;③④证明金属活动性Fe > Cu,Cu > Ag,故金属活动性Fe > Cu > Ag,B正确;①②④证明金属活动性Fe > H,H > Cu,Cu > Ag,故金属活动性Fe > Cu > Ag,C正确。
1(北京东城区二模)下列物质能与FeSO₄溶液反应的是( )
A. Cu B. Hg C. Zn D. Ag
A. Cu B. Hg C. Zn D. Ag
答案:
C [解析]根据常见金属的活动性顺序,题中四种金属中,只有锌排在铁的前面,故锌能与硫酸亚铁溶液发生反应。
2某些金属的活动性顺序如下:

金属活动性由强逐渐减弱
若要除去铜粉中混有的锌粉,可选择的试剂是( )
A. 酒精 B. 稀硫酸
C. 硫酸钾溶液 D. 氯化钠溶液

金属活动性由强逐渐减弱
若要除去铜粉中混有的锌粉,可选择的试剂是( )
A. 酒精 B. 稀硫酸
C. 硫酸钾溶液 D. 氯化钠溶液
答案:
B
3新情境 废旧手机的某些部件中含有Mg、Al、Cu、Ag等金属,如果将废旧手机的这些部件粉碎并浸入足量稀硫酸中充分反应后,过滤,所得固体中含有的金属是( )
A. Cu、Ag B. Mg、Ag C. Al、Cu D. Mg、Al
A. Cu、Ag B. Mg、Ag C. Al、Cu D. Mg、Al
答案:
A [解析]Mg、Al能与稀硫酸反应,Cu、Ag不能与稀硫酸反应。故充分反应后,过滤,所得固体中含有的金属是Cu、Ag。
4(仙桃中考)实验课上,某同学将一定质量的镁粉加入硫酸亚铁溶液中,待反应结束后,过滤,得到滤液和滤渣,下列判断正确的是( )
A. 滤液中一定含有硫酸镁,可能含有硫酸亚铁
B. 若滤液为浅绿色,则滤渣中一定含有镁和铁
C. 向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有镁
D. 所得滤液的质量一定比原溶液的质量大
A. 滤液中一定含有硫酸镁,可能含有硫酸亚铁
B. 若滤液为浅绿色,则滤渣中一定含有镁和铁
C. 向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有镁
D. 所得滤液的质量一定比原溶液的质量大
答案:
A [解析]将一定质量的镁粉加入硫酸亚铁溶液中,镁与硫酸亚铁反应生成硫酸镁和铁,无法确定反应进行的程度,则滤液中一定含有硫酸镁,可能含有硫酸亚铁,A正确;若滤液为浅绿色,说明滤液中含有硫酸亚铁,镁反应完全,则滤渣中一定含有铁,不可能含有镁,B错误;向滤渣中加入稀盐酸,有气泡产生,由于铁和镁都能与稀盐酸反应生成氢气,则滤渣中不一定含有镁,C错误;反应的化学方程式为Mg + FeSO₄ = MgSO₄ + Fe,每24份质量的镁可置换出56份质量的铁,所得滤液的质量一定比原溶液的质量小,D错误。
5(吉林中考)用铝丝、洁净的铜丝、稀盐酸、AgNO₃溶液,验证Al、Cu、Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>_______;发生反应的基本反应类型是________;铝丝使用前需用砂纸打磨的原因是________。
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是________________________。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>_______;发生反应的基本反应类型是________;铝丝使用前需用砂纸打磨的原因是________。
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是________________________。
答案:
(1)Al(或铝) Cu(或铜) 置换反应 除去铝表面致密的氧化铝薄膜,防止其影响反应(或除去铝表面的氧化膜,合理即可)
(2)将铜丝浸入硝酸银溶液中(只要用不超出所给的四种试剂,并得出正确结论的均正确)
(1)Al(或铝) Cu(或铜) 置换反应 除去铝表面致密的氧化铝薄膜,防止其影响反应(或除去铝表面的氧化膜,合理即可)
(2)将铜丝浸入硝酸银溶液中(只要用不超出所给的四种试剂,并得出正确结论的均正确)
6[易错题]金属在日常生活中有着广泛的用途,常见金属活动性顺序如图甲所示。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu (X) Ag Pt Au
金属活动性由强逐渐减弱
甲
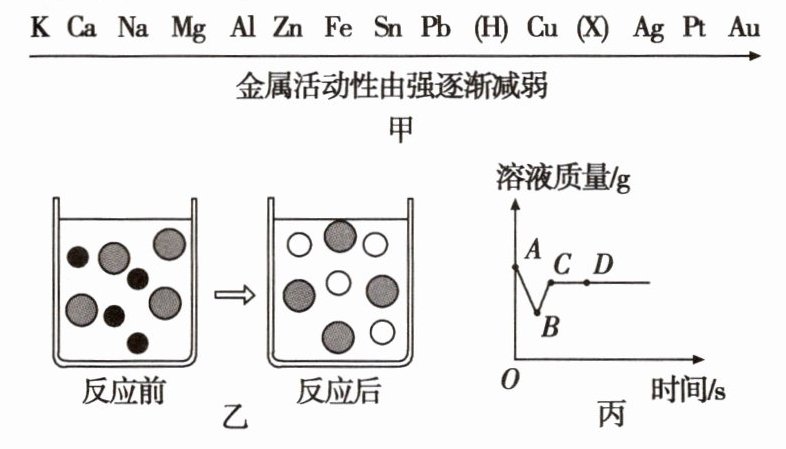
请回答下列问题。
(1)金属活动性顺序中的X是________(填元素符号)。
(2)若向CuSO₄溶液中加入过量的Fe片,充分反应后,能观察到的现象是______________;图乙表示反应前后溶液中存在的主要离子,请写出相关图形代表的离子(填离子符号):“●”________,“○”________。
(3)向一定质量AgNO₃和Cu(NO₃)₂的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图丙所示。图中B点溶液中含有的金属化合物有________(填化学式,下同),图中D点滤渣成分有__________。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu (X) Ag Pt Au
金属活动性由强逐渐减弱
甲

请回答下列问题。
(1)金属活动性顺序中的X是________(填元素符号)。
(2)若向CuSO₄溶液中加入过量的Fe片,充分反应后,能观察到的现象是______________;图乙表示反应前后溶液中存在的主要离子,请写出相关图形代表的离子(填离子符号):“●”________,“○”________。
(3)向一定质量AgNO₃和Cu(NO₃)₂的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图丙所示。图中B点溶液中含有的金属化合物有________(填化学式,下同),图中D点滤渣成分有__________。
答案:
(1)Hg
(2)铁片表面出现红色物质,溶液由蓝色逐渐变为浅绿色 SO₄²⁻ Fe²⁺
(3)Cu(NO₃)₂、Zn(NO₃)₂ Ag、Cu、Zn
[解析]
(1)金属活动性顺序中的X是汞元素。
(2)在金属活动性顺序中,铁排在铜之前,所以铁会和硫酸铜反应生成铜和硫酸亚铁,充分反应后,能观察到的现象是铁片表面出现红色物质,溶液由蓝色逐渐变为浅绿色。由于铁过量,所以反应后的溶液中没有硫酸铜剩余,只有硫酸亚铁,故图乙中图形代表的离子分别是:“●”Cu²⁺,“ ”SO₄²⁻,“○”Fe²⁺。
”SO₄²⁻,“○”Fe²⁺。
(3)金属活动性顺序:Zn > Cu > Ag,向一定质量AgNO₃和Cu(NO₃)₂的混合溶液中加入过量的Zn粉,则Zn与两种金属化合物依次发生反应:
Zn + 2AgNO₃ = Zn(NO₃)₂ + 2Ag
65 216
所以析出银的过程是溶液质量减少的过程;
Zn + Cu(NO₃)₂ = Zn(NO₃)₂ + Cu
65 64
所以析出铜的过程是溶液质量增加的过程。
B点时锌与AgNO₃恰好完全反应,还没有与Cu(NO₃)₂反应,故此时溶液中含有的金属化合物有Cu(NO₃)₂、Zn(NO₃)₂。C点时锌与Cu(NO₃)₂恰好完全反应,置换出全部的银和铜。D点时锌过量,故此时滤渣成分是Ag、Zn、Cu。
易错分析
金属铁发生置换反应时,产生的化合物为亚铁离子化合物,其溶液为浅绿色。
(1)Hg
(2)铁片表面出现红色物质,溶液由蓝色逐渐变为浅绿色 SO₄²⁻ Fe²⁺
(3)Cu(NO₃)₂、Zn(NO₃)₂ Ag、Cu、Zn
[解析]
(1)金属活动性顺序中的X是汞元素。
(2)在金属活动性顺序中,铁排在铜之前,所以铁会和硫酸铜反应生成铜和硫酸亚铁,充分反应后,能观察到的现象是铁片表面出现红色物质,溶液由蓝色逐渐变为浅绿色。由于铁过量,所以反应后的溶液中没有硫酸铜剩余,只有硫酸亚铁,故图乙中图形代表的离子分别是:“●”Cu²⁺,“
 ”SO₄²⁻,“○”Fe²⁺。
”SO₄²⁻,“○”Fe²⁺。(3)金属活动性顺序:Zn > Cu > Ag,向一定质量AgNO₃和Cu(NO₃)₂的混合溶液中加入过量的Zn粉,则Zn与两种金属化合物依次发生反应:
Zn + 2AgNO₃ = Zn(NO₃)₂ + 2Ag
65 216
所以析出银的过程是溶液质量减少的过程;
Zn + Cu(NO₃)₂ = Zn(NO₃)₂ + Cu
65 64
所以析出铜的过程是溶液质量增加的过程。
B点时锌与AgNO₃恰好完全反应,还没有与Cu(NO₃)₂反应,故此时溶液中含有的金属化合物有Cu(NO₃)₂、Zn(NO₃)₂。C点时锌与Cu(NO₃)₂恰好完全反应,置换出全部的银和铜。D点时锌过量,故此时滤渣成分是Ag、Zn、Cu。
易错分析
金属铁发生置换反应时,产生的化合物为亚铁离子化合物,其溶液为浅绿色。
查看更多完整答案,请扫码查看


