9. 为探究锌、铜、铁三种金属的活动性顺序,某学习小组做了如图甲所示实验,实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多,如图
乙所示,下列说法正确的是 ( )
A. 甲图试管①中反应后固体可能不含铁
B. 甲图试管②中反应后固体可能含铁
C. 反应后烧杯中的固体一定含有铁
D. 烧杯中最后所得固体的质量一定大于2a g

乙所示,下列说法正确的是 ( )
A. 甲图试管①中反应后固体可能不含铁
B. 甲图试管②中反应后固体可能含铁
C. 反应后烧杯中的固体一定含有铁
D. 烧杯中最后所得固体的质量一定大于2a g
答案:
D [解析]三种金属的活动性顺序是锌>铁>铜,试管①中铁不与氯化锌反应,试管②中铁会置换出氯化铜中的铜;将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多,说明铁置换出了氯化铜中的铜,即甲图试管②中氯化铜有剩余。由于试管①中铁不与氯化锌反应,所以甲图试管①中固体一定含铁;由上述分析可知,甲图试管②中反应后固体一定不含铁;铁会置换出氯化铜中的铜,但氯化铜的量不确定,所以反应后烧杯中的固体中是否含铁不能确定;加入铁的质量是2a g,每56份质量的铁可以置换出64份质量的铜,且甲图试管②中的a g铁完全反应,所以反应后烧杯中所得固体的质量一定大于2a g。
10. 金属材料在人类的生产和生活中有着广泛的应用。某小组同学对金属活动性的强弱产生了兴趣,如图是他们探究Fe、Cu、Mn三种金属活动性的实验,已知锰元素在硫酸盐中显 + 2价,请完成下列问题。

(1)能验证铁、铜活动性顺序的现象是什么?
(2)C中可观察到明显的现象,写出发生反应的化学方程式。
(3)通过以上实验,判断三种金属的活动性由强到弱的顺序。

(1)能验证铁、铜活动性顺序的现象是什么?
(2)C中可观察到明显的现象,写出发生反应的化学方程式。
(3)通过以上实验,判断三种金属的活动性由强到弱的顺序。
答案:
(1)试管A中无明显现象,试管B中铁片表面有气泡产生且溶液由无色变为浅绿色。
(2)$Mn + FeSO_{4}=Fe + MnSO_{4}$
(3)锰>铁>铜。
(1)试管A中无明显现象,试管B中铁片表面有气泡产生且溶液由无色变为浅绿色。
(2)$Mn + FeSO_{4}=Fe + MnSO_{4}$
(3)锰>铁>铜。
11. 像科学家一样“做科学”——探秘金属的活动性顺序:某研究小组为验证铁、铜、锌、银的金属活动性顺序,设计如图甲所示三个实验(三种金属均已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同)。
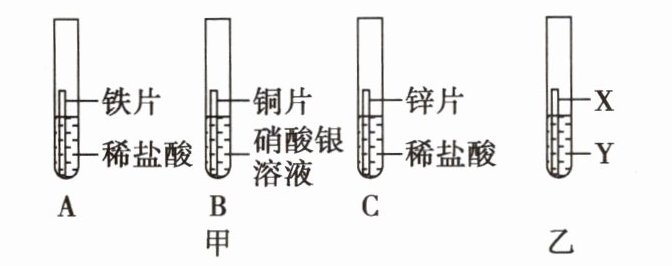
(1)实验前用砂纸打磨金属的目的是 。
(2)一段时间后,观察到B试管中的实验现象为 ,这说明铜比银的金属活动性 (填“强”或“弱”),该反应的化学方程式为 ,该反应属于 (填基本反应类型)。
(3)甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是 。
(4)乙同学认为仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图乙所示,且实现了探究目的。乙同学的实验中X、Y物质分别为 、 。
(5)小华在老师的指导下,把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,充分反应一段时间后,过滤,发现滤液呈无色,此时,滤渣中一定含有 。

(1)实验前用砂纸打磨金属的目的是 。
(2)一段时间后,观察到B试管中的实验现象为 ,这说明铜比银的金属活动性 (填“强”或“弱”),该反应的化学方程式为 ,该反应属于 (填基本反应类型)。
(3)甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是 。
(4)乙同学认为仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图乙所示,且实现了探究目的。乙同学的实验中X、Y物质分别为 、 。
(5)小华在老师的指导下,把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,充分反应一段时间后,过滤,发现滤液呈无色,此时,滤渣中一定含有 。
答案:
(1)除去金属表面的氧化物
(2)铜片表面有银白色固体附着,且溶液由无色变为蓝色 强 $Cu + 2AgNO_{3}=Cu(NO_{3})_{2}+2Ag$ 置换反应
(3)锌反应的速率比铁快
(4)Fe $CuSO_{4}$溶液
(5)银、铜
(1)除去金属表面的氧化物
(2)铜片表面有银白色固体附着,且溶液由无色变为蓝色 强 $Cu + 2AgNO_{3}=Cu(NO_{3})_{2}+2Ag$ 置换反应
(3)锌反应的速率比铁快
(4)Fe $CuSO_{4}$溶液
(5)银、铜
12. (永州中考改编)某研究性学习小组对铁、铜的金属活动性及实验后的废液进行探究,设计下列实验。
Ⅰ. 铁、铜金属活动性比较
|实验步骤|实验现象及结论|
| ---- | ---- |
|①将Cu丝插入盛有2 mL稀硫酸的试管中|Cu丝无变化,没有发生化学反应|
|②将Fe丝插入盛有2 mL稀硫酸的试管中|Fe丝表面有气泡产生,其反应的化学方程式为 |
|③将Fe丝插入盛有2 mL CuSO₄溶液的试管中|Fe丝表面有 色物质覆盖|
结论:通过上面实验,可知Fe的金属活动性比Cu (填“强”或“弱”)。
Ⅱ. 将上面①、②、③实验的液体收集在同一烧杯中,对该烧杯中的废液进行分析。
(1)甲同学观察到废液呈现蓝色,向废液中加入适量铁粉,有气泡产生,由此认为废液中除水外一定含有 (填化学式)。
(2)丙同学设想把废液进行回收,为了将废液中的溶质全部转化为FeSO₄,向废液中加入过量的Fe粉,待反应完全后,过滤,滤渣的成分为 (填化学式)。滤液经蒸发结晶,可得到硫酸亚铁晶体。
Ⅰ. 铁、铜金属活动性比较
|实验步骤|实验现象及结论|
| ---- | ---- |
|①将Cu丝插入盛有2 mL稀硫酸的试管中|Cu丝无变化,没有发生化学反应|
|②将Fe丝插入盛有2 mL稀硫酸的试管中|Fe丝表面有气泡产生,其反应的化学方程式为 |
|③将Fe丝插入盛有2 mL CuSO₄溶液的试管中|Fe丝表面有 色物质覆盖|
结论:通过上面实验,可知Fe的金属活动性比Cu (填“强”或“弱”)。
Ⅱ. 将上面①、②、③实验的液体收集在同一烧杯中,对该烧杯中的废液进行分析。
(1)甲同学观察到废液呈现蓝色,向废液中加入适量铁粉,有气泡产生,由此认为废液中除水外一定含有 (填化学式)。
(2)丙同学设想把废液进行回收,为了将废液中的溶质全部转化为FeSO₄,向废液中加入过量的Fe粉,待反应完全后,过滤,滤渣的成分为 (填化学式)。滤液经蒸发结晶,可得到硫酸亚铁晶体。
答案:
Ⅰ.$Fe + H_{2}SO_{4}=FeSO_{4}+H_{2}\uparrow$ 红 强
Ⅱ.
(1)$CuSO_{4}$、$FeSO_{4}$、$H_{2}SO_{4}$
(2)Fe、Cu
[解析]Ⅰ.将铁丝插入盛有2 mL稀硫酸的试管中,铁与稀硫酸反应生成硫酸亚铁和氢气;将铁丝插入盛有2 mL硫酸铜溶液的试管中,铁与硫酸铜溶液反应生成硫酸亚铁和铜,铁丝表面有红色物质覆盖,说明铁的金属活动性比铜强。Ⅱ.
(1)观察到废液呈现蓝色,说明废液中一定含有硫酸铜;向废液中加入适量铁粉,有气泡产生,说明废液中一定含有硫酸;由于②中铁与稀硫酸反应生成硫酸亚铁,③中铁与硫酸铜溶液反应也生成硫酸亚铁,故废液中还一定含有硫酸亚铁。
(2)向废液中加入过量的铁粉,铁与废液中的硫酸铜反应生成硫酸亚铁和铜,铁与稀硫酸反应生成硫酸亚铁和氢气,过滤后滤渣的成分为反应生成的铜和过量的铁。
Ⅱ.
(1)$CuSO_{4}$、$FeSO_{4}$、$H_{2}SO_{4}$
(2)Fe、Cu
[解析]Ⅰ.将铁丝插入盛有2 mL稀硫酸的试管中,铁与稀硫酸反应生成硫酸亚铁和氢气;将铁丝插入盛有2 mL硫酸铜溶液的试管中,铁与硫酸铜溶液反应生成硫酸亚铁和铜,铁丝表面有红色物质覆盖,说明铁的金属活动性比铜强。Ⅱ.
(1)观察到废液呈现蓝色,说明废液中一定含有硫酸铜;向废液中加入适量铁粉,有气泡产生,说明废液中一定含有硫酸;由于②中铁与稀硫酸反应生成硫酸亚铁,③中铁与硫酸铜溶液反应也生成硫酸亚铁,故废液中还一定含有硫酸亚铁。
(2)向废液中加入过量的铁粉,铁与废液中的硫酸铜反应生成硫酸亚铁和铜,铁与稀硫酸反应生成硫酸亚铁和氢气,过滤后滤渣的成分为反应生成的铜和过量的铁。
查看更多完整答案,请扫码查看


