1(宜宾中考)实验室用氯化钠固体配制质量分数为6%的氯化钠溶液,不会用到的实验仪器是( )
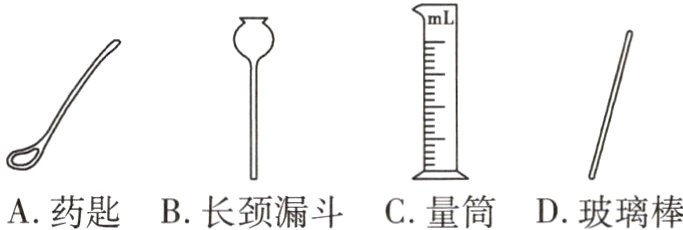
A.药匙
B.长颈漏斗
C.量筒
D.玻璃棒

A.药匙
B.长颈漏斗
C.量筒
D.玻璃棒
答案:
B
2(岳阳中考)化学实验考查时,小芳抽到的考题是“配制40g质量分数为18%的氯化钠溶液”,她的操作正确的是( )
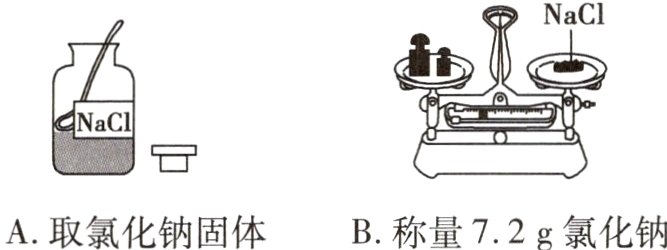
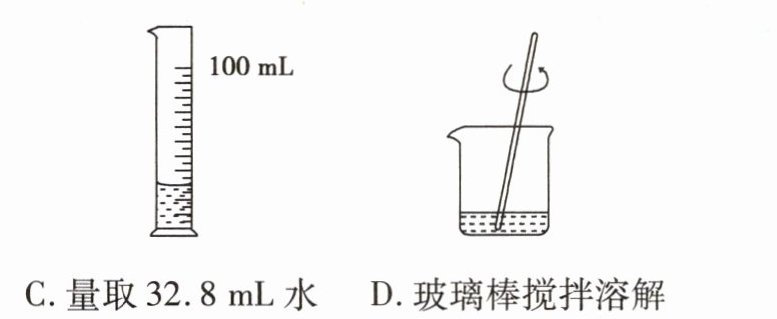
A.取氯化钠固体
B.称量7.2g氯化钠
C.量取32.8mL水
D.玻璃棒搅拌溶解


A.取氯化钠固体
B.称量7.2g氯化钠
C.量取32.8mL水
D.玻璃棒搅拌溶解
答案:
D [解析]取用氯化钠固体时,瓶塞要倒放;托盘天平的使用要遵循“左物右码”的原则;量取32.8mL水,应选用50mL的量筒。
3(怀化中考)实验室欲配制20g质量分数为10%的NaCl溶液,下列实验步骤正确的是( )
A.配制该溶液需要10g氯化钠固体
B.称量氯化钠固体时,将氯化钠放在托盘天平的右盘
C.量取水的过程中仰视读数,所配溶液的溶质质量分数小于10%
D.将称量所得的氯化钠固体放入量筒内溶解
A.配制该溶液需要10g氯化钠固体
B.称量氯化钠固体时,将氯化钠放在托盘天平的右盘
C.量取水的过程中仰视读数,所配溶液的溶质质量分数小于10%
D.将称量所得的氯化钠固体放入量筒内溶解
答案:
C [解析]要配制20g质量分数为10%的NaCl溶液,需要氯化钠的质量为20g×10% = 2g;用托盘天平进行称量时,氯化钠应该放在天平的左盘;量取水时,仰视读数会使所量取的水的体积偏大,最终导致所配溶液的溶质质量分数小于10%;溶解操作应该在烧杯中进行。
4(云南中考)学校某兴趣小组的同学,在实验室配制50g溶质质量分数为15%氯化钠溶液。溶液的配制过程如下图,下列说法正确的是( )
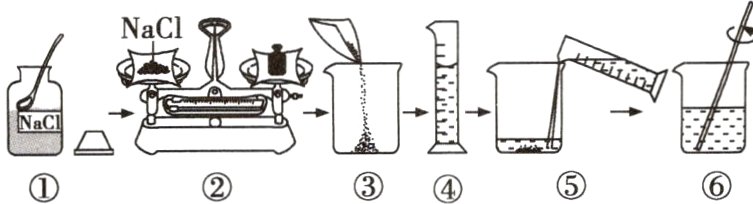
A.若②中的砝码和试剂放反,溶液的溶质质量分数会偏大
B.若③中烧杯内壁有水珠,对溶液的溶质质量分数无影响
C.若④中量取水时俯视读数,溶液的溶质质量分数会偏大
D.将配好的溶液装瓶时,有少量溶液溅出,溶液的溶质质量分数会偏小

A.若②中的砝码和试剂放反,溶液的溶质质量分数会偏大
B.若③中烧杯内壁有水珠,对溶液的溶质质量分数无影响
C.若④中量取水时俯视读数,溶液的溶质质量分数会偏大
D.将配好的溶液装瓶时,有少量溶液溅出,溶液的溶质质量分数会偏小
答案:
C [解析]若②中的砝码和试剂放反,会导致所称取的氯化钠质量偏小,溶液的溶质质量分数会偏小;若③中烧杯内壁有水珠,会导致水的质量偏大,溶液的溶质质量分数会偏小;若④中量取水时俯视读数,会导致水的质量偏小,溶液的溶质质量分数会偏大;溶液具有均一性,将配好的溶液装瓶时,有少量溶液溅出,溶液的溶质质量分数不变。
5为制作叶脉书签,某同学在实验室配制150g溶质质量分数为20%的NaOH溶液,下列有关说法不正确的是( )
A.主要步骤为计算、称量、量取、溶解
B.量取水时俯视读数会使溶液浓度偏大
C.该溶液中溶剂和溶质的质量比为4:1
D.称量过程中指针偏左,应向右调平衡螺母
A.主要步骤为计算、称量、量取、溶解
B.量取水时俯视读数会使溶液浓度偏大
C.该溶液中溶剂和溶质的质量比为4:1
D.称量过程中指针偏左,应向右调平衡螺母
答案:
D
6(吕梁模拟)农业上常用16%的氯化钠溶液选种,兴趣小组的同学在实验室体验了如图所示的选种过程。分析实验过程及氯化钠的溶解度数据,判断下列说法正确的是( )
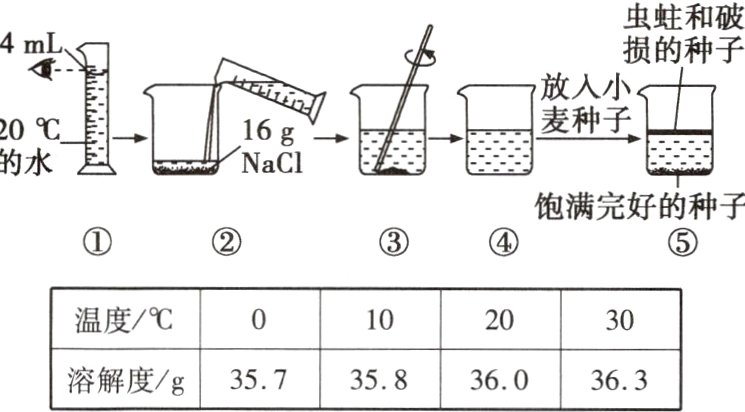
A.④中形成的是氯化钠的饱和溶液
B.③→④过程中溶液温度有明显升高
C.图①操作使得配制的氯化钠溶液浓度偏小
D.饱满种子的密度大于16%的氯化钠溶液的密度

A.④中形成的是氯化钠的饱和溶液
B.③→④过程中溶液温度有明显升高
C.图①操作使得配制的氯化钠溶液浓度偏小
D.饱满种子的密度大于16%的氯化钠溶液的密度
答案:
D [解析]20℃时,氯化钠的溶解度为36.0g,则84mL(合84g)水中能溶解氯化钠的质量为36.0g×$\frac{84 g}{100 g}$=30.24g,而加入的氯化钠的质量为16g,故④中形成的是氯化钠的不饱和溶液;氯化钠溶于水的过程中几乎无热量变化,故③−④过程中溶液温度无明显变化;量筒读数时,视线要与凹液面最低处保持水平,图①中视线与凹液面最高处保持水平,将导致量取的水的体积偏小,则配制的氯化钠溶液浓度偏大;饱满完好的种子在16%的氯化钠溶液中沉至底部,说明饱满种子的密度大于16%的氯化钠溶液的密度。
7(荆州中考改编)实验室配制50g质量分数为6%的NaCl溶液,配制过程包括如下操作。请回答:
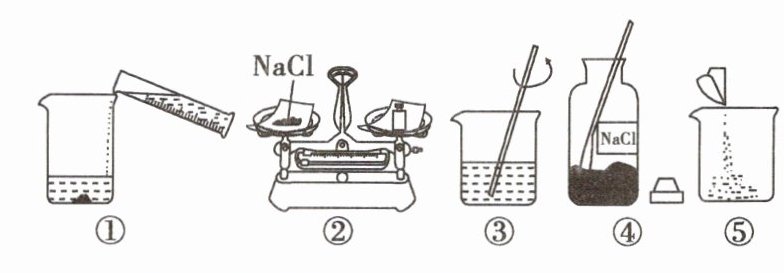
(1)图中使用到的玻璃仪器有_______、量筒、玻璃棒、广口瓶四种。
(2)应称取NaCl固体_______g。在称量的过程中,发现托盘天平的指针向左偏转,此时小明应该_______(填字母)。
A.增加适量NaCl B.减少适量NaCl
C.增加砝码 D.调节天平平衡螺母
(3)溶解时用玻璃棒搅拌的目的是____________________。
(4)该实验中量取的水的体积应为_______mL,应选择_______ (填“20mL”“50mL”或“100mL”)的量筒。
(5)图示中正确的操作顺序为_______(填字母)。
A.④②⑤①③ B.①②③④⑤
C.①②④③⑤ D.④⑤②③①
(6)下列操作会造成所配溶液溶质质量分数偏小的是_______(填字母)。
A.量取蒸馏水时仰视读数
B.量取蒸馏水时俯视读数
C.将称量好的NaCl固体转移至烧杯时,NaCl洒落
D.配好的溶液转移到试剂瓶时,部分溶液溅出

(1)图中使用到的玻璃仪器有_______、量筒、玻璃棒、广口瓶四种。
(2)应称取NaCl固体_______g。在称量的过程中,发现托盘天平的指针向左偏转,此时小明应该_______(填字母)。
A.增加适量NaCl B.减少适量NaCl
C.增加砝码 D.调节天平平衡螺母
(3)溶解时用玻璃棒搅拌的目的是____________________。
(4)该实验中量取的水的体积应为_______mL,应选择_______ (填“20mL”“50mL”或“100mL”)的量筒。
(5)图示中正确的操作顺序为_______(填字母)。
A.④②⑤①③ B.①②③④⑤
C.①②④③⑤ D.④⑤②③①
(6)下列操作会造成所配溶液溶质质量分数偏小的是_______(填字母)。
A.量取蒸馏水时仰视读数
B.量取蒸馏水时俯视读数
C.将称量好的NaCl固体转移至烧杯时,NaCl洒落
D.配好的溶液转移到试剂瓶时,部分溶液溅出
答案:
(1)烧杯
(2)3 B
(3)加快溶解速率
(4)47 50mL
(5)A
(6)AC
[解析]
(2)应称取氯化钠的质量为:50g×6% = 3g;在称量的过程中,发现托盘天平的指针向左偏转,说明氯化钠的质量偏大,则应减少适量NaCl至天平平衡。
(4)所需水的质量为:50g−3g = 47g,即47mL,量筒量程的选择应遵循“大而近”的原则,故应选择50mL的量筒。
(6)量取蒸馏水时仰视读数,读取数值小于实际数值,会导致量取水的体积偏大,溶剂质量偏大,溶质质量分数偏小,A正确;量取蒸馏水时俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,溶剂质量偏小,溶质质量分数偏大,B错误;将称量好的NaCl固体转移至烧杯时,NaCl洒落,会导致溶质质量偏小,溶质质量分数偏小,C正确;配好的溶液转移到试剂瓶时,部分溶液溅出,由于溶液具有均一性,故不影响溶质质量分数的大小,D错误。
(1)烧杯
(2)3 B
(3)加快溶解速率
(4)47 50mL
(5)A
(6)AC
[解析]
(2)应称取氯化钠的质量为:50g×6% = 3g;在称量的过程中,发现托盘天平的指针向左偏转,说明氯化钠的质量偏大,则应减少适量NaCl至天平平衡。
(4)所需水的质量为:50g−3g = 47g,即47mL,量筒量程的选择应遵循“大而近”的原则,故应选择50mL的量筒。
(6)量取蒸馏水时仰视读数,读取数值小于实际数值,会导致量取水的体积偏大,溶剂质量偏大,溶质质量分数偏小,A正确;量取蒸馏水时俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,溶剂质量偏小,溶质质量分数偏大,B错误;将称量好的NaCl固体转移至烧杯时,NaCl洒落,会导致溶质质量偏小,溶质质量分数偏小,C正确;配好的溶液转移到试剂瓶时,部分溶液溅出,由于溶液具有均一性,故不影响溶质质量分数的大小,D错误。
查看更多完整答案,请扫码查看


