3(安徽中考)已知KNO₃在20℃、30℃时的溶解度分别为31.6g、45.8g,某同学按下图所示步骤进行实验,下列说法正确的是 ( )

A. Ⅰ中KNO₃的质量分数为10.0%
B. Ⅱ中溶液是30℃时KNO₃的不饱和溶液
C. Ⅱ中KNO₃的质量分数是Ⅰ中的2倍
D. Ⅲ中有KNO₃晶体析出

A. Ⅰ中KNO₃的质量分数为10.0%
B. Ⅱ中溶液是30℃时KNO₃的不饱和溶液
C. Ⅱ中KNO₃的质量分数是Ⅰ中的2倍
D. Ⅲ中有KNO₃晶体析出
答案:
B [解析]30 ℃时,硝酸钾的溶解度为45.8 g,则30 ℃时,50 g水中最多能溶解22.9 g硝酸钾,则Ⅰ中KNO₃的质量分数为$\frac{5 g}{5 g + 50 g}$×100%≈9.1%;Ⅱ中溶液是30 ℃时10 g硝酸钾溶解在50 g水中形成的,是不饱和溶液;Ⅰ中硝酸钾的质量分数约为9.1%,Ⅱ中硝酸钾的质量分数是$\frac{10 g}{10 g + 50 g}$×100%≈16.7%;20 ℃时,硝酸钾的溶解度为31.6 g,50 g水中最多能溶解15.8 g硝酸钾,而降温前,50 g水中只溶解了10 g硝酸钾,故Ⅲ中没有晶体析出。
4 t℃时,将mgKNO₃的不饱和溶液恒温蒸发水分,直到有少量晶体析出,在此过程中,溶液的溶质质量分数(a%)与时间(t)的变化关系可表示为图中的 ( )


答案:
C [解析]将m g KNO₃的不饱和溶液恒温蒸发水分,在没蒸发水分前该溶液的溶质质量分数不为零;刚开始蒸发水分时,溶质质量不变,溶剂质量减小,所以溶质质量分数增大;当溶液达到饱和后再蒸发水分就会析出晶体,这时溶质质量分数只与该物质的溶解度有关,因为是恒温蒸发,所以温度不变,溶解度不变,溶质质量分数也不变,故选C。
5 将80gM物质加入50g水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,按要求填空。
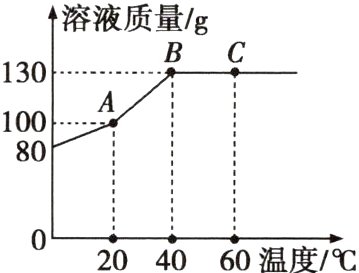
(1)A点时,该溶液的溶质质量分数为 。
(2)A、B、C三点所对应的溶液,属于不饱和溶液的是 (填字母)。
(3)在40℃时,M物质的溶解度为 g,若保持溶剂的质量不变,从C点对应的溶液获得M的晶体,可以采用的方法是 。

(1)A点时,该溶液的溶质质量分数为 。
(2)A、B、C三点所对应的溶液,属于不饱和溶液的是 (填字母)。
(3)在40℃时,M物质的溶解度为 g,若保持溶剂的质量不变,从C点对应的溶液获得M的晶体,可以采用的方法是 。
答案:
(1)50%
(2)C
(3)160 降温结晶(或冷却热饱和溶液)
[解析]
(1)根据溶液的质量随温度的变化曲线可知,A点时,该溶液的质量为100 g,溶液中的M质量为100 g - 50 g = 50 g,该溶液的溶质质量分数为$\frac{50 g}{100 g}$×100% = 50%。
(2)A点对应的溶液随温度的升高质量不断增大,A点对应的溶液中存在未溶解的M,A点对应的溶液是饱和溶液;当温度上升到40 ℃时,溶液的质量为130 g,说明80 g M物质恰好完全溶解,B点对应的溶液是饱和溶液;当温度上升到60 ℃时,溶液的质量不增加,C点对应的溶液是不饱和溶液。A、B、C三点所对应的溶液中属于不饱和溶液的是C。
(3)根据曲线关系图可知,在40 ℃时,80 g M物质与50 g水形成饱和溶液,则40 ℃时,M物质的溶解度为160 g;根据曲线关系图可知,M的溶解度随温度的升高而增大,若保持溶剂的质量不变,从C点对应的溶液获得M的晶体,可以采用的方法是降温结晶。
(1)50%
(2)C
(3)160 降温结晶(或冷却热饱和溶液)
[解析]
(1)根据溶液的质量随温度的变化曲线可知,A点时,该溶液的质量为100 g,溶液中的M质量为100 g - 50 g = 50 g,该溶液的溶质质量分数为$\frac{50 g}{100 g}$×100% = 50%。
(2)A点对应的溶液随温度的升高质量不断增大,A点对应的溶液中存在未溶解的M,A点对应的溶液是饱和溶液;当温度上升到40 ℃时,溶液的质量为130 g,说明80 g M物质恰好完全溶解,B点对应的溶液是饱和溶液;当温度上升到60 ℃时,溶液的质量不增加,C点对应的溶液是不饱和溶液。A、B、C三点所对应的溶液中属于不饱和溶液的是C。
(3)根据曲线关系图可知,在40 ℃时,80 g M物质与50 g水形成饱和溶液,则40 ℃时,M物质的溶解度为160 g;根据曲线关系图可知,M的溶解度随温度的升高而增大,若保持溶剂的质量不变,从C点对应的溶液获得M的晶体,可以采用的方法是降温结晶。
6 甲、乙、丙、丁四只烧杯中,都盛有质量分数为10%的氯化钠溶液90g。
(1)甲杯中投入10gNaCl,搅拌至全部溶解后,所得溶液的溶质质量分数是 。
(2)乙杯中注入10g水稀释,稀释后所得溶液的溶质质量分数是 。
(3)丙杯中加入10g质量分数为20%的NaCl溶液,则混合后溶质质量分数为 。
(4)丁杯中蒸发10g水(无晶体析出)后,溶质的质量分数为 。
(1)甲杯中投入10gNaCl,搅拌至全部溶解后,所得溶液的溶质质量分数是 。
(2)乙杯中注入10g水稀释,稀释后所得溶液的溶质质量分数是 。
(3)丙杯中加入10g质量分数为20%的NaCl溶液,则混合后溶质质量分数为 。
(4)丁杯中蒸发10g水(无晶体析出)后,溶质的质量分数为 。
答案:
(1)19%
(2)9%
(3)11%
(4)11.25%
(1)19%
(2)9%
(3)11%
(4)11.25%
7 已知20℃时氯化钠的溶解度为36g,则在20℃时,将20g氯化钠加入50g水中所得溶液的溶质质量分数为 (精确至0.1%)。将20g氯化钠加入 g水中,才能得到溶质质量分数为10%的氯化钠溶液。
答案:
26.5% 180
8 一定温度下,将80g氯化钠固体放入盛有200g水的烧杯中,充分搅拌后,尚有8g氯化钠未溶解,则形成的氯化钠溶液中溶质的质量分数是多少?(保留1位小数)
答案:
解:由题意知,所得溶液中溶质的质量为80 g - 8 g = 72 g,溶液的质量为72 g + 200 g = 272 g
氯化钠溶液中溶质的质量分数为$\frac{72 g}{272 g}$×100%≈26.5%
答:形成的氯化钠溶液中溶质的质量分数约为26.5%。
氯化钠溶液中溶质的质量分数为$\frac{72 g}{272 g}$×100%≈26.5%
答:形成的氯化钠溶液中溶质的质量分数约为26.5%。
9 新考法(重庆中考A卷)将34.2kgAl₂(SO₄)₃溶液的溶质质量分数由10%变为20%可以用不同方法。请选择一种方法进行计算(只写出计算过程,不答具体操作)。
答案:
解:方法一、蒸发浓缩。
需要蒸发水的质量为34.2 kg - $\frac{34.2 kg×10\%}{20\%}$= 17.1 kg。
或方法二、加Al₂(SO₄)₃。
设需要加入的Al₂(SO₄)₃的质量为m。
$\frac{m + 34.2 kg×10\%}{m + 34.2 kg}$×100% = 20%,
解得m = 4.275 kg。
需要蒸发水的质量为34.2 kg - $\frac{34.2 kg×10\%}{20\%}$= 17.1 kg。
或方法二、加Al₂(SO₄)₃。
设需要加入的Al₂(SO₄)₃的质量为m。
$\frac{m + 34.2 kg×10\%}{m + 34.2 kg}$×100% = 20%,
解得m = 4.275 kg。
10 白酒的“度数”指的是白酒中酒精的含量。这里的含量不是指质量分数,而是体积分数。例如52度的白酒表示100mL白酒中含有52mL酒精(常温时)。蒸馏水密度为1g/mL,酒精密度为0.8g/mL,则40度的白酒中溶质的质量分数约为(忽略分子间的间隔造成的体积变化)( )
A. 40% B. 60%
C. 34.8% D. 无法判断
A. 40% B. 60%
C. 34.8% D. 无法判断
答案:
C [解析]设40度的白酒溶液体积为100 mL,则100 mL 40度的白酒中酒精的质量为0.8 g/mL×40 mL = 32 g,水的质量为1 g/mL×60 mL = 60 g,40度的白酒中溶质的质量分数约为$\frac{32 g}{32 g + 60 g}$×100% = 34.8%。
1.(抚顺中考)某品牌补钙剂的主要成分是碳酸钙,实验小组的同学取该补钙剂2.5g,加入溶质质量分数为7.3%的稀盐酸至不再有气泡产生,共收集到二氧化碳0.88g(补钙剂中其他成分均不与稀盐酸反应)。请计算:
(1)该补钙剂中碳酸钙的质量分数。
(2)所用稀盐酸的质量。
答案:
解:设该补钙剂中碳酸钙的质量为$x$,所加稀盐酸中溶质的质量为$y$。
$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$
100 73 44
$x$ $y$ 0.88 g
$\frac{100}{44}=\frac{x}{0.88g}$ $x = 2g$
$\frac{73}{44}=\frac{y}{0.88g}$ $y = 1.46g$
(1) 该补钙剂中碳酸钙的质量分数为$\frac{2g}{2.5g}\times100\% = 80\%$
(2) 所用稀盐酸的质量为$1.46g\div7.3\% = 20g$
答:该补钙剂中碳酸钙的质量分数为80%;所用稀盐酸的质量为20 g。
$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$
100 73 44
$x$ $y$ 0.88 g
$\frac{100}{44}=\frac{x}{0.88g}$ $x = 2g$
$\frac{73}{44}=\frac{y}{0.88g}$ $y = 1.46g$
(1) 该补钙剂中碳酸钙的质量分数为$\frac{2g}{2.5g}\times100\% = 80\%$
(2) 所用稀盐酸的质量为$1.46g\div7.3\% = 20g$
答:该补钙剂中碳酸钙的质量分数为80%;所用稀盐酸的质量为20 g。
2.(湖北十堰调研)往水电解器中加入110g蒸馏水和8gNa₂SO₄(Na₂SO₄不参与反应,仅起增加水的导电性的作用),然后通直流电进行电解,当负极得到2g气体时,停止实验。计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中Na₂SO₄的质量分数是多少?
答案:
解:设停止实验时,电解消耗水的质量为$x$。
$2H_{2}O\xlongequal{通电}2H_{2}\uparrow+O_{2}\uparrow$
36 4
$x$ 2 g
$\frac{36}{4}=\frac{x}{2g}$ $x = 18g$
剩余溶液中$Na_{2}SO_{4}$的质量分数为$\frac{8g}{110g + 8g - 18g}\times100\% = 8\%$
答:
(1) 停止实验时,电解消耗水的质量是18 g。
(2) 停止实验后,剩余溶液中$Na_{2}SO_{4}$的质量分数是8%。
[解析]根据生成的氢气的质量和对应的化学方程式,计算停止实验时电解消耗水的质量,进而计算剩余溶液中$Na_{2}SO_{4}$的质量分数。
$2H_{2}O\xlongequal{通电}2H_{2}\uparrow+O_{2}\uparrow$
36 4
$x$ 2 g
$\frac{36}{4}=\frac{x}{2g}$ $x = 18g$
剩余溶液中$Na_{2}SO_{4}$的质量分数为$\frac{8g}{110g + 8g - 18g}\times100\% = 8\%$
答:
(1) 停止实验时,电解消耗水的质量是18 g。
(2) 停止实验后,剩余溶液中$Na_{2}SO_{4}$的质量分数是8%。
[解析]根据生成的氢气的质量和对应的化学方程式,计算停止实验时电解消耗水的质量,进而计算剩余溶液中$Na_{2}SO_{4}$的质量分数。
3.(安徽合肥模拟)化学小组想定量分析某稀盐酸的组成,用一块废弃大理石与之反应。实验过程中不考虑盐酸的挥发。实验测得数据如图所示。

(1)产生CO₂的质量为_______g。
(2)所用稀盐酸的溶质质量分数是多少?
答案:
(1) 5.5
(2) 解:由图可知,加入50 g盐酸时,盐酸完全反应,此时生成$CO_{2}$的质量为$20g + 50g - 64.5g = 5.5g$
设所用稀盐酸的溶质质量是$x$。
$CaCO_{3}+2HCl=CaCl_{2}+CO_{2}\uparrow+H_{2}O$
73 44
$x$ 5.5 g
$\frac{73}{44}=\frac{x}{5.5g}$ $x = 9.125g$
所用稀盐酸的溶质质量分数为$\frac{9.125g}{50g}\times100\% = 18.25\%$
答:所用稀盐酸的溶质质量分数是18.25%。
[解析]
(1) 盐酸和碳酸钙反应生成氯化钙、二氧化碳和水,生成的二氧化碳逸出,反应前后减少的质量就是二氧化碳的质量。产生$CO_{2}$的总质量为$20g + 75g - 89.5g = 5.5g$。
(2) 根据二氧化碳的质量求出氯化氢的质量,进而求出所用稀盐酸的溶质质量分数。
(1) 5.5
(2) 解:由图可知,加入50 g盐酸时,盐酸完全反应,此时生成$CO_{2}$的质量为$20g + 50g - 64.5g = 5.5g$
设所用稀盐酸的溶质质量是$x$。
$CaCO_{3}+2HCl=CaCl_{2}+CO_{2}\uparrow+H_{2}O$
73 44
$x$ 5.5 g
$\frac{73}{44}=\frac{x}{5.5g}$ $x = 9.125g$
所用稀盐酸的溶质质量分数为$\frac{9.125g}{50g}\times100\% = 18.25\%$
答:所用稀盐酸的溶质质量分数是18.25%。
[解析]
(1) 盐酸和碳酸钙反应生成氯化钙、二氧化碳和水,生成的二氧化碳逸出,反应前后减少的质量就是二氧化碳的质量。产生$CO_{2}$的总质量为$20g + 75g - 89.5g = 5.5g$。
(2) 根据二氧化碳的质量求出氯化氢的质量,进而求出所用稀盐酸的溶质质量分数。
4.(齐齐哈尔中考)小明同学用某铁粉样品(杂质不溶于水,也不与酸反应)进行了如图所示实验,请回答下列问题:

(1)样品中铁的质量是_______g。
(2)本实验最终所得不饱和溶液的溶质质量分数是多少?
答案:
(1) 5.6
(2) 解:设生成氢气的质量为$x$,氯化亚铁的质量为$y$。
$Fe+2HCl=FeCl_{2}+H_{2}\uparrow$
56 127 2
5.6 g $y$ $x$
$\frac{56}{2}=\frac{5.6g}{x}$ $x = 0.2g$
$\frac{56}{127}=\frac{5.6g}{y}$ $y = 12.7g$
所得不饱和溶液的溶质质量分数是$\frac{12.7g}{121.6g + 6g - 0.4g - 0.2g}\times100\% = 10\%$
答:所得不饱和溶液的溶质质量分数是10%。
(1) 5.6
(2) 解:设生成氢气的质量为$x$,氯化亚铁的质量为$y$。
$Fe+2HCl=FeCl_{2}+H_{2}\uparrow$
56 127 2
5.6 g $y$ $x$
$\frac{56}{2}=\frac{5.6g}{x}$ $x = 0.2g$
$\frac{56}{127}=\frac{5.6g}{y}$ $y = 12.7g$
所得不饱和溶液的溶质质量分数是$\frac{12.7g}{121.6g + 6g - 0.4g - 0.2g}\times100\% = 10\%$
答:所得不饱和溶液的溶质质量分数是10%。
1.(聊城中考)实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图所示。

请回答下列问题:
(1)反应生成氧气的质量为_______g。
(2)原过氧化氢溶液的溶质质量分数是多少?
答案:
(1) 1.6
(2) 解:设参加反应的过氧化氢的质量为$x$。
$2H_{2}O_{2}\xlongequal{MnO_{2}}2H_{2}O+O_{2}\uparrow$
68 32
$x$ 1.6 g
$\frac{68}{32}=\frac{x}{1.6g}$ $x = 3.4g$
原过氧化氢溶液的溶质质量分数为$\frac{3.4g}{68g}\times100\% = 5\%$
答:原过氧化氢溶液的溶质质量分数是5%。
(1) 1.6
(2) 解:设参加反应的过氧化氢的质量为$x$。
$2H_{2}O_{2}\xlongequal{MnO_{2}}2H_{2}O+O_{2}\uparrow$
68 32
$x$ 1.6 g
$\frac{68}{32}=\frac{x}{1.6g}$ $x = 3.4g$
原过氧化氢溶液的溶质质量分数为$\frac{3.4g}{68g}\times100\% = 5\%$
答:原过氧化氢溶液的溶质质量分数是5%。
2. 为测定某硫酸溶液的溶质质量分数,某化学小组同学向100g该硫酸溶液中滴加BaCl₂溶液,测得生成沉淀的质量随加入BaCl₂溶液的质量关系如图。(提示:BaCl₂ + H₂SO₄ === BaSO₄↓ + 2HCl)
计算:
(1)恰好完全反应时,生成沉淀的质量为_______g。
(2)硫酸溶液中溶质的质量分数。
(3)恰好完全反应时过滤,应向所得溶液中加入多少克水,才能得到2.5%的稀盐酸?

答案:
(1) 23.3
解:设100 g硫酸溶液中溶质的质量为$x$,反应生成氯化氢的质量为$y$。
$BaCl_{2}+H_{2}SO_{4}=BaSO_{4}\downarrow+2HCl$
98 233 73
$x$ 23.3 g $y$
$\frac{98}{233}=\frac{x}{23.3g}$ $\frac{233}{73}=\frac{23.3g}{y}$
$x = 9.8g$ $y = 7.3g$
(2) 硫酸溶液中溶质的质量分数为$\frac{9.8g}{100g}\times100\% = 9.8\%$
(3) 恰好完全反应时所得溶液的质量为$100g + 100g - 23.3g = 176.7g$
设向所得溶液中加入水的质量为$m$。
$(176.7g + m)\times2.5\% = 7.3g$
$m = 115.3g$
答:
(2) 硫酸溶液中溶质的质量分数为9.8%;
(3) 应向所得溶液中加入115.3 g水,才能得到2.5%的稀盐酸。
(1) 23.3
解:设100 g硫酸溶液中溶质的质量为$x$,反应生成氯化氢的质量为$y$。
$BaCl_{2}+H_{2}SO_{4}=BaSO_{4}\downarrow+2HCl$
98 233 73
$x$ 23.3 g $y$
$\frac{98}{233}=\frac{x}{23.3g}$ $\frac{233}{73}=\frac{23.3g}{y}$
$x = 9.8g$ $y = 7.3g$
(2) 硫酸溶液中溶质的质量分数为$\frac{9.8g}{100g}\times100\% = 9.8\%$
(3) 恰好完全反应时所得溶液的质量为$100g + 100g - 23.3g = 176.7g$
设向所得溶液中加入水的质量为$m$。
$(176.7g + m)\times2.5\% = 7.3g$
$m = 115.3g$
答:
(2) 硫酸溶液中溶质的质量分数为9.8%;
(3) 应向所得溶液中加入115.3 g水,才能得到2.5%的稀盐酸。
3.(河北九地市模拟)某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:向四个烧杯中分别加入16g石灰石样品,分别向其中加入一定量稀盐酸,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水也不与稀盐酸反应)。

请计算:
(1)石灰石中碳酸钙的质量分数为_______。
(2)所用稀盐酸的溶质质量分数是多少?(写出具体计算过程)
答案:
(1) 70%
(2) 解:设稀盐酸中溶质的质量分数为$x$。
$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$
100 73
4 g $20g\times x$
$\frac{100}{73}=\frac{4g}{20g\times x}$ $x = 14.6\%$
答:稀盐酸中溶质的质量分数为14.6%。
[解析]
(1) 根据题意可知,石灰石中碳酸钙的质量分数为$\frac{16g - 4.8g}{16g}\times100\% = 70\%$。
(2) 由表中数据可知,每加入20 g稀盐酸,消耗碳酸钙的质量为$16g - 12g = 4g$,根据碳酸钙与稀盐酸反应的化学方程式,由碳酸钙的质量计算所用稀盐酸的溶质质量分数。
(1) 70%
(2) 解:设稀盐酸中溶质的质量分数为$x$。
$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$
100 73
4 g $20g\times x$
$\frac{100}{73}=\frac{4g}{20g\times x}$ $x = 14.6\%$
答:稀盐酸中溶质的质量分数为14.6%。
[解析]
(1) 根据题意可知,石灰石中碳酸钙的质量分数为$\frac{16g - 4.8g}{16g}\times100\% = 70\%$。
(2) 由表中数据可知,每加入20 g稀盐酸,消耗碳酸钙的质量为$16g - 12g = 4g$,根据碳酸钙与稀盐酸反应的化学方程式,由碳酸钙的质量计算所用稀盐酸的溶质质量分数。
4.(宜昌中考)铜锌合金外观似金子,化学小组为检测其中锌的质量分数,按下列流程进行探究实验。充分反应,所得数据如图所示(忽略盐酸的挥发):

求:(1)生成氢气的总质量为_______g。
(2)合金中锌的质量分数。
(3)稀盐酸中溶质的质量分数。
答案:
(1) 0.2
(2) 解:设参加反应的锌的质量为$x$,稀盐酸中反应的溶质的质量为$y$。
$Zn+2HCl=ZnCl_{2}+H_{2}\uparrow$
65 73 2
$x$ $y$ 0.2 g
$\frac{65}{2}=\frac{x}{0.2g}$ $x = 6.5g$
$\frac{73}{2}=\frac{y}{0.2g}$ $y = 7.3g$
合金中锌的质量分数为$\frac{6.5g}{20g}\times100\% = 32.5\%$
(3) 由题图数据分析可知,第一次加入50 g稀盐酸,产生氢气的质量为$20g + 50g - 69.9g = 0.1g$;第二次加入50 g稀盐酸,产生氢气的质量为$69.9g + 50g - 119.8g = 0.1g$;第三次加入的稀盐酸没有反应
故稀盐酸中溶质的质量分数为$\frac{7.3g}{100g}\times100\% = 7.3\%$
答:
(2) 合金中锌的质量分数为32.5%;
(3) 稀盐酸中溶质的质量分数为7.3%。
(1) 0.2
(2) 解:设参加反应的锌的质量为$x$,稀盐酸中反应的溶质的质量为$y$。
$Zn+2HCl=ZnCl_{2}+H_{2}\uparrow$
65 73 2
$x$ $y$ 0.2 g
$\frac{65}{2}=\frac{x}{0.2g}$ $x = 6.5g$
$\frac{73}{2}=\frac{y}{0.2g}$ $y = 7.3g$
合金中锌的质量分数为$\frac{6.5g}{20g}\times100\% = 32.5\%$
(3) 由题图数据分析可知,第一次加入50 g稀盐酸,产生氢气的质量为$20g + 50g - 69.9g = 0.1g$;第二次加入50 g稀盐酸,产生氢气的质量为$69.9g + 50g - 119.8g = 0.1g$;第三次加入的稀盐酸没有反应
故稀盐酸中溶质的质量分数为$\frac{7.3g}{100g}\times100\% = 7.3\%$
答:
(2) 合金中锌的质量分数为32.5%;
(3) 稀盐酸中溶质的质量分数为7.3%。
查看更多完整答案,请扫码查看


