3将20℃时接近饱和的氢氧化钙溶液持续升温的过程中一定不会发生变化的是( )
A.溶液中溶质的质量
B.溶液的质量
C.溶液中溶剂的质量
D.溶液中溶质的质量分数
A.溶液中溶质的质量
B.溶液的质量
C.溶液中溶剂的质量
D.溶液中溶质的质量分数
答案:
C
4下列关于溶解度的说法中,正确的是( )
A.在温度不变时,溶剂的量越多,溶质的溶解度越大
B.搅拌可以使固体物质的溶解度增大
C.固体的溶解度随温度的升高而增大
D.20℃时,50g水中最多能溶解18g氯化钠,则20℃时氯化钠的溶解度为36g
A.在温度不变时,溶剂的量越多,溶质的溶解度越大
B.搅拌可以使固体物质的溶解度增大
C.固体的溶解度随温度的升高而增大
D.20℃时,50g水中最多能溶解18g氯化钠,则20℃时氯化钠的溶解度为36g
答案:
D [解析]固体物质的溶解度与溶剂质量多少无关,故A错;搅拌只能加快固体物质的溶解速率,不能改变其溶解度,故B错;有的固体溶解度是随温度升高而减小的,如Ca(OH)$_2$,故C错。
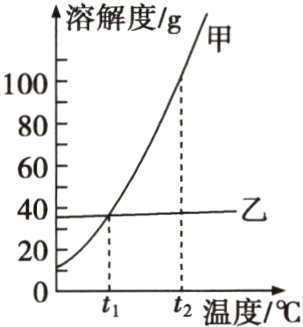
5(达州中考)t₁℃时,将相同质量的KNO₃和KCl分别加入盛有100g水的甲、乙烧杯中,充分搅拌后现象如图Ⅰ所示,图Ⅱ为两物质的溶解度曲线。以下说法正确的是( )

A.甲烧杯中的溶质为KNO₃
B.将温度升高到t₂℃时,乙烧杯中仍然有固体剩余
C.若KNO₃中混有少量KCl,可采用蒸发结晶的方法提纯KNO₃
D.若取t₃℃时KNO₃和KCl的饱和溶液各100g,降温至t₂℃,析出晶体较多的是KNO₃

A.甲烧杯中的溶质为KNO₃
B.将温度升高到t₂℃时,乙烧杯中仍然有固体剩余
C.若KNO₃中混有少量KCl,可采用蒸发结晶的方法提纯KNO₃
D.若取t₃℃时KNO₃和KCl的饱和溶液各100g,降温至t₂℃,析出晶体较多的是KNO₃
答案:
D [解析]$t_1$℃时,氯化钾的溶解度大于硝酸钾的溶解度,则甲烧杯中的溶质为氯化钾;硝酸钾和氯化钾的溶解度均随温度的升高而增大,且$t_2$℃时硝酸钾和氯化钾的溶解度相等,则将温度升高到$t_2$℃,乙烧杯中的固体全部溶解;硝酸钾的溶解度受温度影响变化较大,氯化钾的溶解度受温度影响变化较小,若硝酸钾中混有少量氯化钾,可采用降温结晶的方法提纯硝酸钾。
6烧开水时,加热不久在锅底会出现许多气泡,这说明气体的溶解度随________而减小;打开汽水瓶盖时,有大量气泡由瓶口逸出,这是因为________________________。由此可以得出,增大CO₂气体在水中的溶解度应采用的方法是__________,因此食品工业上在常温下制汽水、啤酒时常采取________的方法增大CO₂的溶解度。
答案:
温度升高 打开瓶盖后瓶内压强减小,CO$_2$在水中的溶解度减小 增大压强或降低温度 加压
7(荆州中考改编)以下是KNO₃和NaCl在不同温度时的溶解度及对应的溶解度曲线。请回答:
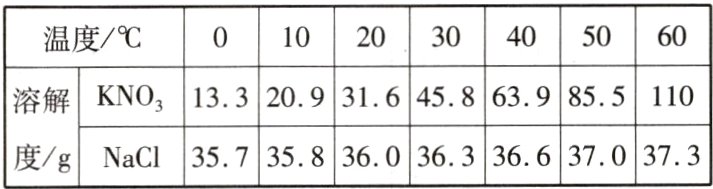
(1)10℃时,KNO₃的溶解度比NaCl的________。
(2)将不饱和的NaCl溶液变成饱和溶液的方法是__________。
(3)代表KNO₃溶解度曲线的是________(填“甲”或“乙”)。
(4)若KNO₃中混有少量NaCl,可采用________的方法提纯KNO₃。
(5)t₁的范围为________(填序号)。
A.10 ~ 20
B.20 ~ 30
C.30 ~ 40
D.50 ~ 60


(1)10℃时,KNO₃的溶解度比NaCl的________。
(2)将不饱和的NaCl溶液变成饱和溶液的方法是__________。
(3)代表KNO₃溶解度曲线的是________(填“甲”或“乙”)。
(4)若KNO₃中混有少量NaCl,可采用________的方法提纯KNO₃。
(5)t₁的范围为________(填序号)。
A.10 ~ 20
B.20 ~ 30
C.30 ~ 40
D.50 ~ 60
答案:
(1)小 (2)加入NaCl固体(或蒸发溶剂) (3)甲 (4)降温结晶(或冷却热饱和溶液) (5)B
[解析](5)分析题表中的数据可知,0~20 ℃时,NaCl的溶解度大于KNO₃的溶解度,30~60 ℃时,NaCl的溶解度小于KNO₃的溶解度,所以KNO₃和NaCl溶解度相同的温度应在20~30 ℃之间。
[解析](5)分析题表中的数据可知,0~20 ℃时,NaCl的溶解度大于KNO₃的溶解度,30~60 ℃时,NaCl的溶解度小于KNO₃的溶解度,所以KNO₃和NaCl溶解度相同的温度应在20~30 ℃之间。
8(辽宁丹东模拟)如图是甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线,请回答下列问题。

(1)交点P的含义是____________________。
(2)使乙溶液中的溶质结晶的方法通常是________。
(3)t₂℃时,将甲、乙、丙各30g分别充分溶于100g水中,所得溶液质量大小关系为__________,其中________是不饱和溶液。
(4)t₁℃时,将等质量的甲、乙、丙三种饱和溶液分别升温至t₂℃,所得溶液中溶剂的质量大小关系为__________。

(1)交点P的含义是____________________。
(2)使乙溶液中的溶质结晶的方法通常是________。
(3)t₂℃时,将甲、乙、丙各30g分别充分溶于100g水中,所得溶液质量大小关系为__________,其中________是不饱和溶液。
(4)t₁℃时,将等质量的甲、乙、丙三种饱和溶液分别升温至t₂℃,所得溶液中溶剂的质量大小关系为__________。
答案:
(1)$t_1$℃时,甲、丙物质的溶解度相等,均为20 g (2)蒸发结晶 (3)甲 = 乙 > 丙 甲、乙 (4)甲 = 丙 > 乙
[解析](1)通过分析溶解度曲线可知,交点P的含义是$t_1$℃时,甲、丙物质的溶解度相等,均为20 g。
(2)乙物质的溶解度受温度变化影响较小,所以将乙溶液中的溶质结晶的方法通常是蒸发结晶。
(3)$t_2$℃时,甲、乙物质的溶解度均为40 g,丙物质的溶解度小于20 g,所以将甲、乙、丙各30 g分别充分溶于100 g水中,甲、乙固体全部溶解,丙固体不能全部溶解,则所得溶液质量大小关系为甲 = 乙 > 丙,其中甲、乙是不饱和溶液。(4)$t_1$℃时,乙物质的溶解度最大,甲、丙物质的溶解度相等,等质量的甲、乙、丙三种饱和溶液中,甲、丙溶液中的溶剂质量相等且大于乙溶液,将它们分别升温至$t_2$℃,溶剂质量不会发生变化,所以所得溶液中溶剂的质量大小关系为甲 = 丙 > 乙。
[解析](1)通过分析溶解度曲线可知,交点P的含义是$t_1$℃时,甲、丙物质的溶解度相等,均为20 g。
(2)乙物质的溶解度受温度变化影响较小,所以将乙溶液中的溶质结晶的方法通常是蒸发结晶。
(3)$t_2$℃时,甲、乙物质的溶解度均为40 g,丙物质的溶解度小于20 g,所以将甲、乙、丙各30 g分别充分溶于100 g水中,甲、乙固体全部溶解,丙固体不能全部溶解,则所得溶液质量大小关系为甲 = 乙 > 丙,其中甲、乙是不饱和溶液。(4)$t_1$℃时,乙物质的溶解度最大,甲、丙物质的溶解度相等,等质量的甲、乙、丙三种饱和溶液中,甲、丙溶液中的溶剂质量相等且大于乙溶液,将它们分别升温至$t_2$℃,溶剂质量不会发生变化,所以所得溶液中溶剂的质量大小关系为甲 = 丙 > 乙。
查看更多完整答案,请扫码查看


