第88页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
14. (3分)已知暗紫色固体$A$在加热的条件下反应生成$B$、$C$和$D$,$D$能使带火星的木条复燃。在反应②中,$B$可以加快反应速率。
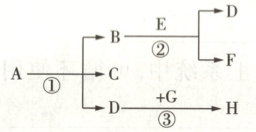
(1)若$E$为液体,则$F$为
(2)若$H$能使澄清石灰水变浑浊,$G$为黑色固体,则反应③的化学方程式为
(3)若将$G$放入$D$中燃烧时,可观察到火星四射,生成黑色固体$H$,为防止集气瓶被炸裂,应该在集气瓶底放少量

(1)若$E$为液体,则$F$为
$H_2O$
(填化学式)。(2)若$H$能使澄清石灰水变浑浊,$G$为黑色固体,则反应③的化学方程式为
$C+O_2\overset{点燃}{=}CO_2$
。(3)若将$G$放入$D$中燃烧时,可观察到火星四射,生成黑色固体$H$,为防止集气瓶被炸裂,应该在集气瓶底放少量
水(或细沙)
。
答案:
14.
(1)$H_2O$
(2)$C+O_2\overset{点燃}{=}CO_2$
(3)水(或细沙)
(1)$H_2O$
(2)$C+O_2\overset{点燃}{=}CO_2$
(3)水(或细沙)
15. (4分)用如图所示实验验证质量守恒定律。
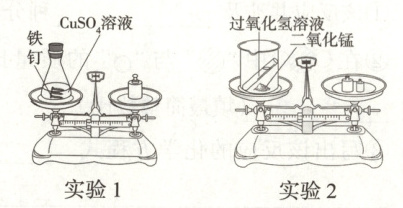
(1)实验1中,最终天平指针
(2)实验2中,将过氧化氢溶液倒入烧杯后,发生反应的化学方程式为

(1)实验1中,最终天平指针
不偏转
(填“向左偏转”“向右偏转”或“不偏转”),从微观角度分析,化学反应中质量守恒的原因是在化学反应前后,原子的种类、数目
、质量都不改变。(2)实验2中,将过氧化氢溶液倒入烧杯后,发生反应的化学方程式为
$2H_2O_2\overset{MnO_2}{=}2H_2O+O_2\uparrow$
。该实验结果不能用于验证质量守恒定律的原因是反应生成的氧气会逸散到空气中,反应后剩余物质的总质量减少,导致天平不平衡
。
答案:
15.
(1)不偏转 数目
(2)$2H_2O_2\overset{MnO_2}{=}2H_2O+O_2\uparrow$ 反应生成的氧气会逸散到空气中,反应后剩余物质的总质量减少,导致天平不平衡
(1)不偏转 数目
(2)$2H_2O_2\overset{MnO_2}{=}2H_2O+O_2\uparrow$ 反应生成的氧气会逸散到空气中,反应后剩余物质的总质量减少,导致天平不平衡
16. 小林同学在做探究质量守恒定律的实验时,称取$2.4g$镁条在点燃的条件下与充足的空气反应,其反应的化学方程式为
【提出问题】
固体质量为什么会小于$4.0g$,是否发生了其他反应?
【查阅资料】
镁在空气中燃烧时,除了与氧气反应外,还可能发生反应:
①$2Mg+CO_{2}\overset{点燃}{=}C+2MgO$
②$3Mg+N_{2}\overset{点燃}{=}Mg_{3}N_{2}$
【猜想与假设】
反应后固体质量小于$4.0g$是由于发生了反应
【实验探究】
根据初中化学所学知识用如图所示装置除去空气中的氧气得到氮气(含少量稀有气体)。可燃物应选择的物质是
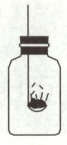
A.木炭
B.红磷
C.硫粉
选择的理由是
将点燃的镁条伸入所制得的氮气中,镁条在氮气中剧烈燃烧。
【实验结论】
$2.4g$镁在空气中完全反应后所得固体质量小于$4.0g$,是由于生成的产物是
$2Mg+O_2\overset{点燃}{=}2MgO$
,实验完毕后,称得所得固体的质量小于$4.0g$。【提出问题】
固体质量为什么会小于$4.0g$,是否发生了其他反应?
【查阅资料】
镁在空气中燃烧时,除了与氧气反应外,还可能发生反应:
①$2Mg+CO_{2}\overset{点燃}{=}C+2MgO$
②$3Mg+N_{2}\overset{点燃}{=}Mg_{3}N_{2}$
【猜想与假设】
反应后固体质量小于$4.0g$是由于发生了反应
②
(填“①”或“②”),其理由是根据化学方程式可知,2.4g镁与氧气反应生成的$MgO$为4.0g,与二氧化碳反应生成4.0g的氧化镁和0.6g的碳;而2.4g镁与纯氮气反应生成的$Mg_3N_2$约为3.33g且空气中氮气的含量高,因此固体质量小于4.0g是因为发生了反应②
。【实验探究】
根据初中化学所学知识用如图所示装置除去空气中的氧气得到氮气(含少量稀有气体)。可燃物应选择的物质是
B
(填字母)。
A.木炭
B.红磷
C.硫粉
选择的理由是
红磷和氧气反应只生成固体
。将点燃的镁条伸入所制得的氮气中,镁条在氮气中剧烈燃烧。
【实验结论】
$2.4g$镁在空气中完全反应后所得固体质量小于$4.0g$,是由于生成的产物是
氧化镁和氮化镁
的混合物。
答案:
16.$2Mg+O_2\overset{点燃}{=}2MgO$【猜想与假设】② 根据化学方程式可知,2.4g镁与氧气反应生成的$MgO$为4.0g,与二氧化碳反应生成4.0g的氧化镁和0.6g的碳;而2.4g镁与纯氮气反应生成的$Mg_3N_2$约为3.33g且空气中氮气的含量高,因此固体质量小于4.0g是因为发生了反应② 【实验探究】B 红磷和氧气反应只生成固体 【实验结论】氧化镁和氮化镁
查看更多完整答案,请扫码查看


