第82页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
11. (11 分)某学习小组以“二氧化碳的制取与性质”为主题开展学习实践活动。
【活动一】制取二氧化碳气体
(1)图 1 中,仪器 a 的名称是
A. 可随时控制反应的发生和停止
B. 可以节约药品
C. 可以加快反应速率

(2)同学们利用图 2 数字化实验比较块状和粉末状碳酸钙与稀盐酸反应的速率,反应发生后,锥形瓶内压强的变化如图 3 所示。
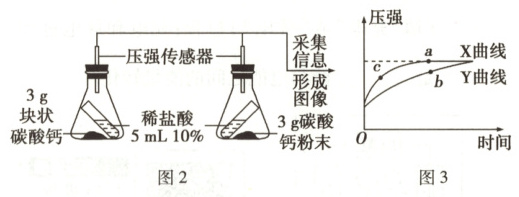
①图 2 的对比实验中,要保证两个实验装置完全相同、环境温度相同、反应开始的时间相同、碳酸钙质量相同、
②图 3 中表示块状碳酸钙与稀盐酸反应的曲线是______(填“X”或“Y”),依据是______。
③图 3 中表示碳酸钙与稀盐酸完全反应的点是
④实验室制取 4.4g 二氧化碳,理论上消耗溶质质量分数为 10%的稀盐酸质量是
【活动二】探究二氧化碳气体的性质
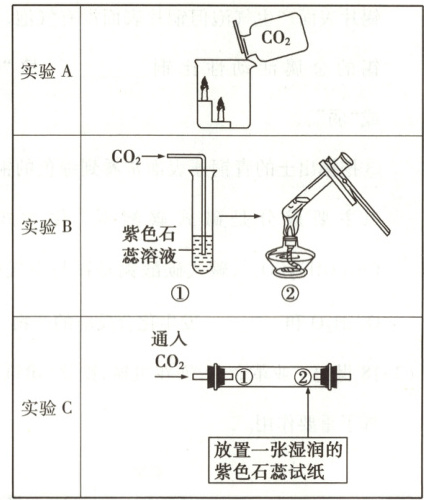
(3)实验 A:观察到蜡烛自下而上依次熄灭,由此得知 CO₂具有的物理性质是
(4)实验 B:②的试管中,溶液的颜色变化是______,该化学反应基本类型是______。
(5)实验 C:为验证 CO₂能与 H₂O 反应,玻璃管中①处应放置
【活动一】制取二氧化碳气体
(1)图 1 中,仪器 a 的名称是
长颈漏斗
;与装置 A 相比,装置 B 的优点是A、B
(填标号)。A. 可随时控制反应的发生和停止
B. 可以节约药品
C. 可以加快反应速率

(2)同学们利用图 2 数字化实验比较块状和粉末状碳酸钙与稀盐酸反应的速率,反应发生后,锥形瓶内压强的变化如图 3 所示。

①图 2 的对比实验中,要保证两个实验装置完全相同、环境温度相同、反应开始的时间相同、碳酸钙质量相同、
稀盐酸的体积(质量)与溶质质量分数
相同,只有这样才能保证研究的变量只有一个。②图 3 中表示块状碳酸钙与稀盐酸反应的曲线是______(填“X”或“Y”),依据是______。
③图 3 中表示碳酸钙与稀盐酸完全反应的点是
a
(填“a”“b”或“c”)。④实验室制取 4.4g 二氧化碳,理论上消耗溶质质量分数为 10%的稀盐酸质量是
73
g。【活动二】探究二氧化碳气体的性质

(3)实验 A:观察到蜡烛自下而上依次熄灭,由此得知 CO₂具有的物理性质是
密度比空气大
。(4)实验 B:②的试管中,溶液的颜色变化是______,该化学反应基本类型是______。
(5)实验 C:为验证 CO₂能与 H₂O 反应,玻璃管中①处应放置
干燥的紫色石蕊试纸
。
答案:
11.
(1)长颈漏斗 A、B
(2)①稀盐酸的体积(质量)与溶质质量分数(两点答全才给分,其他答案意思合理也给分)
②Y 相同时间内块状产生的压强小或产生相同压强时块状用的时间多或者块状反应速率慢(从粉末状碳酸钙角度解释,合理即给分)
③a ④73
(3)密度比空气大
(4)由红色变为紫色 分解反应
(5)干燥的紫色石蕊试纸
(1)长颈漏斗 A、B
(2)①稀盐酸的体积(质量)与溶质质量分数(两点答全才给分,其他答案意思合理也给分)
②Y 相同时间内块状产生的压强小或产生相同压强时块状用的时间多或者块状反应速率慢(从粉末状碳酸钙角度解释,合理即给分)
③a ④73
(3)密度比空气大
(4)由红色变为紫色 分解反应
(5)干燥的紫色石蕊试纸
12. (11 分)金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。
(1)人类对三种金属的广泛使用顺序是铜、铁、铝,这和自然、技术、经济发展等因素密切相关,与
A. 金属的硬度
B. 金属在地壳中的含量
C. 金属的活动性顺序
(2)青铜器时代开始了大规模冶炼金属,推动了工具革命。
①青铜是人类最早使用的金属材料,青铜的主要成分是铜和锡。青铜比金属铜和金属锡
②将打磨后的铜片和锡片分别放入稀盐酸中,锡片表面产生气泡但铜片表面没有气泡,说明锡的金属活动性比铜
③挖掘出土的青铜器表面常看到绿色的铜锈,其主要成分是碱式碳酸铜[化学式为 Cu₂(OH)₂CO₃],碱式碳酸铜是铜与空气中的 O₂、H₂O 和
(3)18 世纪工业革命中,铁在机械、铁路、建筑上发挥了重要作用。
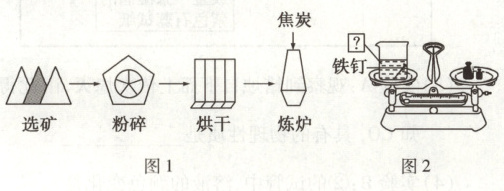
现代工业炼铁的工艺流程如图 1 所示,请结合图文信息,回答下列问题。
①工业炼铁要从多角度考虑铁矿石选用,你认为需要考虑的因素是
②烘干过程中水分子的
③向炼炉中加入的焦炭,除了与氧气反应外,还与
④同学们在验证质量守恒定律时也用到了铁。为了达到实验目的,图 2 实验的烧杯中加入的液体试剂是硫酸铜溶液,发生的化学反应方程式是
(4)1954 年电解法发明后分离出了纯铝。
近代铝及铝合金因为轻量化等优点被广泛应用。铝的金属活动性比铁强,但常温下铝比铁的抗腐蚀性能力强,其原因是铝与氧气反应,生成了致密的氧化物
(1)人类对三种金属的广泛使用顺序是铜、铁、铝,这和自然、技术、经济发展等因素密切相关,与
C
(填标号)也有很大关系。A. 金属的硬度
B. 金属在地壳中的含量
C. 金属的活动性顺序
(2)青铜器时代开始了大规模冶炼金属,推动了工具革命。
①青铜是人类最早使用的金属材料,青铜的主要成分是铜和锡。青铜比金属铜和金属锡
硬
(填“软”或“硬”)。②将打磨后的铜片和锡片分别放入稀盐酸中,锡片表面产生气泡但铜片表面没有气泡,说明锡的金属活动性比铜
强
(填“强”或“弱”)。③挖掘出土的青铜器表面常看到绿色的铜锈,其主要成分是碱式碳酸铜[化学式为 Cu₂(OH)₂CO₃],碱式碳酸铜是铜与空气中的 O₂、H₂O 和
二氧化碳
发生化合反应的产物。(3)18 世纪工业革命中,铁在机械、铁路、建筑上发挥了重要作用。

现代工业炼铁的工艺流程如图 1 所示,请结合图文信息,回答下列问题。
①工业炼铁要从多角度考虑铁矿石选用,你认为需要考虑的因素是
含铁量高
(答一点)。②烘干过程中水分子的
间隔
发生改变。③向炼炉中加入的焦炭,除了与氧气反应外,还与
二氧化碳
发生反应生成一氧化碳。④同学们在验证质量守恒定律时也用到了铁。为了达到实验目的,图 2 实验的烧杯中加入的液体试剂是硫酸铜溶液,发生的化学反应方程式是
Fe + CuSO₄=Cu + FeSO₄
。能否将硫酸铜溶液换为稀硫酸?请说明你的观点并解释:不能,因为生成的氢气扩散到空气中而无法验证质量守恒
。(4)1954 年电解法发明后分离出了纯铝。
近代铝及铝合金因为轻量化等优点被广泛应用。铝的金属活动性比铁强,但常温下铝比铁的抗腐蚀性能力强,其原因是铝与氧气反应,生成了致密的氧化物
Al₂O₃
(填化学式),阻止铝制品的进一步腐蚀;而铁锈具有疏松的特点,更容易吸收空气中的水和氧气
,加速铁的锈蚀。
答案:
12.
(1)C
(2)①硬 ②强 ③二氧化碳
(3)①含铁量高(或运输成本低、开采成本低、冶炼污染小等合理即可)
②间隔 ③二氧化碳
④Fe + CuSO₄=Cu + FeSO₄
不能,因为生成的氢气扩散到空气中而无法验证质量守恒(两点答全才给分,其他答案意思合理也给分)
(4)Al₂O₃ 水和氧气
(1)C
(2)①硬 ②强 ③二氧化碳
(3)①含铁量高(或运输成本低、开采成本低、冶炼污染小等合理即可)
②间隔 ③二氧化碳
④Fe + CuSO₄=Cu + FeSO₄
不能,因为生成的氢气扩散到空气中而无法验证质量守恒(两点答全才给分,其他答案意思合理也给分)
(4)Al₂O₃ 水和氧气
查看更多完整答案,请扫码查看


