第78页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
11. (11 分)实验是学习化学的重要途径。
Ⅰ. 实验课上,同学们设计了下图的装置,完成了“实验室制取气体”的实验。

(1) 实验室利用过氧化氢溶液和二氧化锰制取氧气,请写出化学方程式:
(2) 选择 A 作为发生装置,收集较纯净的氧气,应选择的收集装置是
(3) 上述制取氧气的装置还可以用来制取二氧化碳,制取二氧化碳选择的试剂为
(4) 在过氧化氢溶液和二氧化锰制取氧气实验中,二氧化锰起催化作用,反应前后二氧化锰的质量和
Ⅱ. 很多门把手都是铜质镀铬的,为了了解铬与常见金属镁、铜在金属活动性顺序表中的相对位置关系,同学们进行如下探究活动:
【查阅资料】
①铬(Cr)是银白色有光泽的金属,在空气中其表面能生成致密氧化膜。硫酸亚铬($CrSO_{4}$)溶液为蓝色的溶液。
②硫酸镁溶液为无色的溶液。
【猜想与假设】
(5) 猜想三种金属在金属活动性顺序表中的相对位置关系:
猜想一:$Cr > Mg > Cu$;
猜想二:
猜想三:$Mg > Cu > Cr$。
【实验过程】进行如下实验:
(6) ①将经过处理的铬片放入盛有稀硫酸的试管中,观察到的现象是:铬片表面产生气泡,
②将经过处理的镁片放入硫酸亚铬溶液中,观察到镁片上有新的固体生成,溶液由蓝色变为无色,可以得出镁的金属活动性比铬
【实验结论】
三种金属在金属活动性顺序表中的相对位置关系:猜想二成立。
【反思与评价】
(7) 在做①实验前应对铬片进行怎样的处理
Ⅰ. 实验课上,同学们设计了下图的装置,完成了“实验室制取气体”的实验。

(1) 实验室利用过氧化氢溶液和二氧化锰制取氧气,请写出化学方程式:
2H₂O₂ \stackrel{MnO₂}{=} 2H₂O + O₂↑
。(2) 选择 A 作为发生装置,收集较纯净的氧气,应选择的收集装置是
E
(填字母)。发生装置也可以选择 B,相比装置 A 而言,选择装置 B 作为发生装置的优点是可以控制反应速率
。(3) 上述制取氧气的装置还可以用来制取二氧化碳,制取二氧化碳选择的试剂为
石灰石(或大理石)
和稀盐酸。(4) 在过氧化氢溶液和二氧化锰制取氧气实验中,二氧化锰起催化作用,反应前后二氧化锰的质量和
化学性质
不变。实验结束后从混合物中回收二氧化锰需进行的操作是:过滤
、洗涤、干燥。Ⅱ. 很多门把手都是铜质镀铬的,为了了解铬与常见金属镁、铜在金属活动性顺序表中的相对位置关系,同学们进行如下探究活动:
【查阅资料】
①铬(Cr)是银白色有光泽的金属,在空气中其表面能生成致密氧化膜。硫酸亚铬($CrSO_{4}$)溶液为蓝色的溶液。
②硫酸镁溶液为无色的溶液。
【猜想与假设】
(5) 猜想三种金属在金属活动性顺序表中的相对位置关系:
猜想一:$Cr > Mg > Cu$;
猜想二:
Mg>Cr>Cu
;猜想三:$Mg > Cu > Cr$。
【实验过程】进行如下实验:
(6) ①将经过处理的铬片放入盛有稀硫酸的试管中,观察到的现象是:铬片表面产生气泡,
溶液由无色变为蓝色
。根据实验现象,猜想三不成立。②将经过处理的镁片放入硫酸亚铬溶液中,观察到镁片上有新的固体生成,溶液由蓝色变为无色,可以得出镁的金属活动性比铬
强
(填“强”或“弱”)。【实验结论】
三种金属在金属活动性顺序表中的相对位置关系:猜想二成立。
【反思与评价】
(7) 在做①实验前应对铬片进行怎样的处理
用砂纸打磨
。反应后铬片完全溶解试管底部没有晶体析出,如何判断所得溶液中$CrSO_{4}$是否饱和向所得溶液中加入硫酸亚铬,看是否溶解
。
答案:
$11.(1)2H₂O₂ \stackrel{MnO₂}{=} 2H₂O + O₂↑ (2)E $可以控制反应速率
(3)石灰石(或大理石)
(4)化学性质 过滤
(5)Mg>Cr>Cu
(6)①溶液由无色变为蓝色 ②强
(7)用砂纸打磨 向所得溶液中加入硫酸亚铬,看是否溶解
(3)石灰石(或大理石)
(4)化学性质 过滤
(5)Mg>Cr>Cu
(6)①溶液由无色变为蓝色 ②强
(7)用砂纸打磨 向所得溶液中加入硫酸亚铬,看是否溶解
12. (11 分)化学科学已经日益渗透到社会生活的各个方面,它与我们的生产、生活息息相关。
Ⅰ. 秉承“节能环保”原则,新能源汽车引领汽车产业转型,我国在此领域取得显著成就。
2024 年中国新能源汽车的销量达到 1 300 万辆,连续十年在全球排名第一,占了全球总销量的 70%。
燃油汽车和新能源汽车是当今社会交通工具的两大主流类型。燃油汽车燃料燃烧不仅产生大量二氧化碳,还会释放一氧化碳等有害物质。发展新能源汽车是降低燃料消耗量、改善大气环境的重要举措。
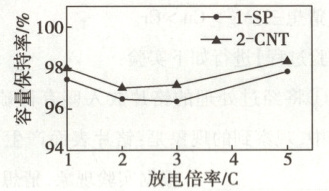
纯电动汽车因其能源利用率高、结构简单、噪声小等优点成为近年来使用最广的新能源汽车。纯电动汽车利用电池储能后放电,驱动汽车行驶,但因电池安全性、充电时长、续航里程、使用寿命等因素导致其发展受限。我国科研人员通过研究对比了添加 1-SP 和 2-CNT 两种导电剂对纯电动汽车中磷酸亚铁锂电池使用寿命的影响,结果如图(容量保持率越高,代表电池使用寿命越长)。
在“双碳”目标下,新能源汽车将迎来更广阔的市场前景和发展空间。
(1) 钢铁是生产汽车不可或缺的原材料之一。工业上常用 CO 来还原赤铁矿(主要成分是$Fe_{2}O_{3}$)冶炼金属铁,其发生反应的化学方程式为
(2) 汽车的配件中有:a. 合成橡胶轮胎,b. 铝合金轮毂,c. 塑料保险杠,d. 钢架车门,e. 玻璃车窗,f. 高强度丙纶纤维安全带等,其中主要由有机合成材料制成的是
(3) 传统燃油汽车大多采用从石油里提炼的汽油或柴油作为燃料,石油属于
(4) 已知磷酸亚铁锂($LiFePO_{4}$)中锂元素为 +1 价,则磷酸亚铁锂中磷元素的化合价为
(5) 对比图中的两条曲线,得出的结论是:在实验研究的放电倍率范围内,当放电倍率相同时,
Ⅱ. 农谚“雷雨发庄稼”是指空气中的氮气在雷电环境下,能转变为含氮化合物,最终生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐,其中氮元素是植物生长所需的重要的营养元素。硝酸的形成过程如图所示。
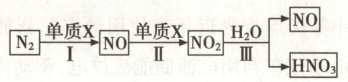
(6) 图中单质 X 是一种常见气体,其化学式为
(7) 反应Ⅱ在常温下即可发生,该反应的化学方程式为
A. 化合反应
B. 分解反应
C. 置换反应
D. 氧化反应
(8) 为了提高氮原子的利用率,图中可循环利用的物质是
(9) 在实验室通常采用以下方法制取 NO:$4NH_{3} + 5O_{2}\xlongequal{一定条件}4NO + 6R$,R 的化学式为
Ⅰ. 秉承“节能环保”原则,新能源汽车引领汽车产业转型,我国在此领域取得显著成就。
2024 年中国新能源汽车的销量达到 1 300 万辆,连续十年在全球排名第一,占了全球总销量的 70%。
燃油汽车和新能源汽车是当今社会交通工具的两大主流类型。燃油汽车燃料燃烧不仅产生大量二氧化碳,还会释放一氧化碳等有害物质。发展新能源汽车是降低燃料消耗量、改善大气环境的重要举措。
纯电动汽车因其能源利用率高、结构简单、噪声小等优点成为近年来使用最广的新能源汽车。纯电动汽车利用电池储能后放电,驱动汽车行驶,但因电池安全性、充电时长、续航里程、使用寿命等因素导致其发展受限。我国科研人员通过研究对比了添加 1-SP 和 2-CNT 两种导电剂对纯电动汽车中磷酸亚铁锂电池使用寿命的影响,结果如图(容量保持率越高,代表电池使用寿命越长)。

在“双碳”目标下,新能源汽车将迎来更广阔的市场前景和发展空间。
(1) 钢铁是生产汽车不可或缺的原材料之一。工业上常用 CO 来还原赤铁矿(主要成分是$Fe_{2}O_{3}$)冶炼金属铁,其发生反应的化学方程式为
3CO + Fe₂O₃ \stackrel{高温}{=} 2Fe + 3CO₂
。(2) 汽车的配件中有:a. 合成橡胶轮胎,b. 铝合金轮毂,c. 塑料保险杠,d. 钢架车门,e. 玻璃车窗,f. 高强度丙纶纤维安全带等,其中主要由有机合成材料制成的是
a、c、f
(填选项序号)。(3) 传统燃油汽车大多采用从石油里提炼的汽油或柴油作为燃料,石油属于
不可再生
(填“可再生”或“不可再生”)能源。使用燃油作为汽车燃料会造成空气污染,写出汽车尾气中的一种空气污染物CO
。(4) 已知磷酸亚铁锂($LiFePO_{4}$)中锂元素为 +1 价,则磷酸亚铁锂中磷元素的化合价为
+5
。(5) 对比图中的两条曲线,得出的结论是:在实验研究的放电倍率范围内,当放电倍率相同时,
添加2-CNT的磷酸亚铁锂电池使用寿命比添加1-SP的长
。Ⅱ. 农谚“雷雨发庄稼”是指空气中的氮气在雷电环境下,能转变为含氮化合物,最终生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐,其中氮元素是植物生长所需的重要的营养元素。硝酸的形成过程如图所示。

(6) 图中单质 X 是一种常见气体,其化学式为
O₂
。(7) 反应Ⅱ在常温下即可发生,该反应的化学方程式为
2NO + O₂ = 2NO₂
,该反应属于A、D
(填字母)。A. 化合反应
B. 分解反应
C. 置换反应
D. 氧化反应
(8) 为了提高氮原子的利用率,图中可循环利用的物质是
NO
(填化学式)。(9) 在实验室通常采用以下方法制取 NO:$4NH_{3} + 5O_{2}\xlongequal{一定条件}4NO + 6R$,R 的化学式为
H₂O
。
答案:
$12.(1)3CO + Fe₂O₃ \stackrel{高温}{=} 2Fe + 3CO₂ $
(2)a、c、f
(3)不可再生 CO
(4)+5
(5)添加2-CNT的磷酸亚铁锂电池使用寿命比添加1-SP的长
(6)O₂
(7)2NO + O₂ = 2NO₂ A、D
(8)NO
(9)H₂O
(2)a、c、f
(3)不可再生 CO
(4)+5
(5)添加2-CNT的磷酸亚铁锂电池使用寿命比添加1-SP的长
(6)O₂
(7)2NO + O₂ = 2NO₂ A、D
(8)NO
(9)H₂O
查看更多完整答案,请扫码查看


