第10页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
11. (10分)实验是学习化学的重要途径。
(一)实验室用高锰酸钾制取氧气
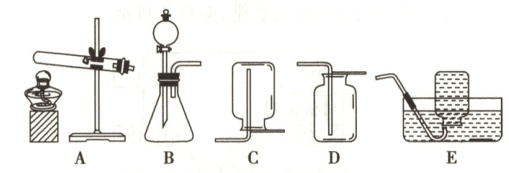
(1)反应原理:用化学方程式表示为________________________。
(2)制取装置:发生装置应选(填序号);考虑到氧气不易溶于水、(写一条物理性质),收集装置可选E或D。
(3)注意事项:排水法收集氧气结束时,为避免因试管内压强减小而产生倒吸现象,应先(填序号)。
A. 熄灭酒精灯
B. 将导管移出水面
(二)探究金属的化学性质
准备实验:
(4)为避免金属表面氧化膜干扰实验,可进行的操作是________________(写一种物理方法)。
进行实验:
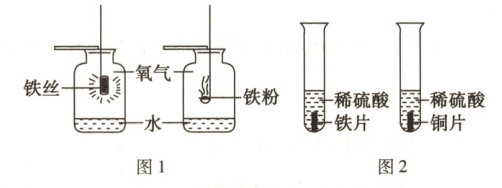
(5)图1集气瓶内放入少量水的作用是________________________。点燃等质量的铁丝与铁粉,铁粉燃烧更剧烈的原因是________________________。
(6)图2中铁片表面产生,铜片表面无明显现象,说明金属活动性:铁铜(填“>”或“<”)。
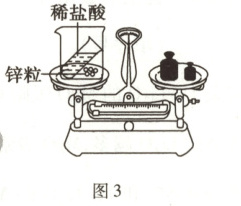
(7)如图3所示,天平平衡。倾斜烧杯,使盐酸与锌粒接触,托盘天平指针将逐渐偏(填“左”或“右”)。
(一)实验室用高锰酸钾制取氧气

(1)反应原理:用化学方程式表示为________________________。
(2)制取装置:发生装置应选(填序号);考虑到氧气不易溶于水、(写一条物理性质),收集装置可选E或D。
(3)注意事项:排水法收集氧气结束时,为避免因试管内压强减小而产生倒吸现象,应先(填序号)。
A. 熄灭酒精灯
B. 将导管移出水面
(二)探究金属的化学性质
准备实验:
(4)为避免金属表面氧化膜干扰实验,可进行的操作是________________(写一种物理方法)。
进行实验:


(5)图1集气瓶内放入少量水的作用是________________________。点燃等质量的铁丝与铁粉,铁粉燃烧更剧烈的原因是________________________。
(6)图2中铁片表面产生,铜片表面无明显现象,说明金属活动性:铁铜(填“>”或“<”)。
(7)如图3所示,天平平衡。倾斜烧杯,使盐酸与锌粒接触,托盘天平指针将逐渐偏(填“左”或“右”)。
答案:
11.
(1)$2KMnO_4 \xlongequal{\triangle}K_2MnO_4 + MnO_2 + O_2\uparrow$
(2)A 密度比空气大
(3)B
(4)用砂纸打磨金属表面
(5)防止高温熔融物溅落炸裂瓶底 铁粉与氧气接触面积更大,反应更剧烈
(6)气泡(或氢气) >
(7)右
(1)$2KMnO_4 \xlongequal{\triangle}K_2MnO_4 + MnO_2 + O_2\uparrow$
(2)A 密度比空气大
(3)B
(4)用砂纸打磨金属表面
(5)防止高温熔融物溅落炸裂瓶底 铁粉与氧气接触面积更大,反应更剧烈
(6)气泡(或氢气) >
(7)右
12. (11分)海水是宝贵的自然资源,含有多种化学物质。
(一)海水成分
海水中几种主要离子浓度见下表:

(1)海水属于(填“纯净物”或“混合物”)。
(2)请依据上表写出海水中含量最多的金属元素是。
(3)全球30%的镁来自海水,我国是全球最大的镁生产国。制镁的部分反应原理可表示为: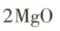
 ,则X的化学式为。
,则X的化学式为。
(4)海水中某些藻类物质可将空气中的氮气转化为氮的化合物,这是海洋中氮循环的关键,这一过程是将太阳能转化为能。
(5)海水蒸发的过程中,水分子不发生变化的是(填序号)。
A. 分子构成
B. 分子种类
C. 分子间隔
(二)海水制氢
通过海水制取氢气的方法和技术在不断发展。
(6)传统海水制氢气,一般先通过(填“过滤”或“蒸发”)除去海水中的不溶物,之后经技术处理获得较为纯净的淡水,再进行电解。
(7)写出电解水的化学方程式:________________________。
(8)我国科学家正在研究海水原位制氢技术,通过膜分离技术使水分子进入电解槽。
①聚四氟乙烯是常用的膜材料,它属于(填“金属材料”或“合成材料”)。
②在电解海水制氢系统中,通常在电解槽中加入NaOH。推测加入NaOH的目的是________________________。
③电解槽内溶液的pH通常在13.8左右,可使用金属镍做电极,据此说明镍具有的化学性质是。
(9)储氢车间内,应设置的标志有(填序号)。

(一)海水成分
海水中几种主要离子浓度见下表:

(1)海水属于(填“纯净物”或“混合物”)。
(2)请依据上表写出海水中含量最多的金属元素是。
(3)全球30%的镁来自海水,我国是全球最大的镁生产国。制镁的部分反应原理可表示为:
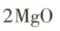
 ,则X的化学式为。
,则X的化学式为。(4)海水中某些藻类物质可将空气中的氮气转化为氮的化合物,这是海洋中氮循环的关键,这一过程是将太阳能转化为能。
(5)海水蒸发的过程中,水分子不发生变化的是(填序号)。
A. 分子构成
B. 分子种类
C. 分子间隔
(二)海水制氢
通过海水制取氢气的方法和技术在不断发展。
(6)传统海水制氢气,一般先通过(填“过滤”或“蒸发”)除去海水中的不溶物,之后经技术处理获得较为纯净的淡水,再进行电解。
(7)写出电解水的化学方程式:________________________。
(8)我国科学家正在研究海水原位制氢技术,通过膜分离技术使水分子进入电解槽。
①聚四氟乙烯是常用的膜材料,它属于(填“金属材料”或“合成材料”)。
②在电解海水制氢系统中,通常在电解槽中加入NaOH。推测加入NaOH的目的是________________________。
③电解槽内溶液的pH通常在13.8左右,可使用金属镍做电极,据此说明镍具有的化学性质是。
(9)储氢车间内,应设置的标志有(填序号)。

答案:
12.
(1)混合物
(2)Na(或钠)
(3)$SiO_2$
(4)化学
(5)AB
(6)过滤
(7)$2H_2O\xlongequal{通电}2H_2\uparrow + O_2\uparrow$
(8)①合成材料 ②增强水的导电性
③耐碱性(或能与强碱共存)
(9)AB
(1)混合物
(2)Na(或钠)
(3)$SiO_2$
(4)化学
(5)AB
(6)过滤
(7)$2H_2O\xlongequal{通电}2H_2\uparrow + O_2\uparrow$
(8)①合成材料 ②增强水的导电性
③耐碱性(或能与强碱共存)
(9)AB
查看更多完整答案,请扫码查看


