第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
14. (11 分)在学习了常见的酸和碱后,某化学兴趣小组的同学围绕“酸碱中和反应”,在老师引导下开展实验探究活动,请你参与下列活动。
实验一:
【实验探究】将氢氧化钾溶液与稀硫酸混合,观察不到明显现象,为证明氢氧化钾溶液与稀硫酸发生了反应,三位同学进行了以下实验。
(1) 测定溶液 pH 变化的方法
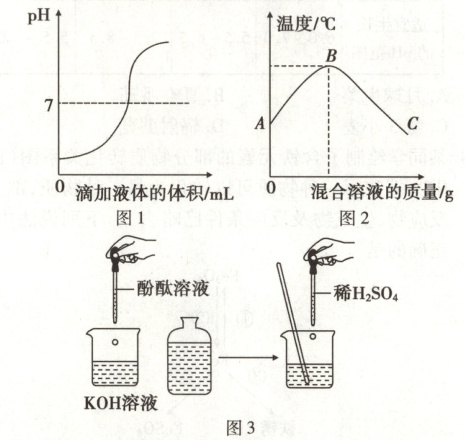
甲同学在实验过程中测得 pH 变化如图 1 所示,则该同学是将
A. 氢氧化钾溶液滴入稀硫酸中
B. 稀硫酸滴入氢氧化钾溶液中
(2) 测混合过程中的温度变化
乙同学在实验过程中测得反应混合溶液的温度变化如图 2 所示,说明稀硫酸与氢氧化钾溶液发生的反应是
(3) 借助酸碱指示剂
丙同学通过图 3 所示实验,他观察到
【提出问题】针对反应后溶液中溶质的成分,大家纷纷提出了猜想。
【猜想与假设】
猜想一:只有 K₂SO₄;猜想二:有 K₂SO₄ 和 H₂SO₄;猜想三:有
【进行实验】为了验证猜想,学习小组选用 Fe₂O₃ 粉末、BaCl₂ 溶液,进行如下探究:

【实验结论】通过探究,同学们一致确定猜想二是正确的。
【评价与反思】
(4) 丁同学针对上述方案提出疑问,认为方案二是不合理的,理由是
(5) 同学们经过反思与讨论,最后认为方案一中的 Fe₂O₃ 粉末可以用下列的某些物质代替,也能得到同样的实验结论,请你选出可用试剂的字母序号
A. Mg
B. CuO
C. KCl
D. Na₂CO₃
实验二:从溶液电导率变化探究中和反应
小组同学根据图 4 进行相关实验,利用电导率传感器分别测试 A、B 试管反应过程中溶液的电导率变化。(已知电导率越大,溶液中自由移动的离子浓度越大)
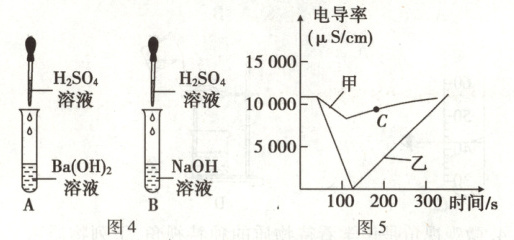
(7) 图 5 中表示 B 试管电导率变化的是
实验一:
【实验探究】将氢氧化钾溶液与稀硫酸混合,观察不到明显现象,为证明氢氧化钾溶液与稀硫酸发生了反应,三位同学进行了以下实验。
(1) 测定溶液 pH 变化的方法
甲同学在实验过程中测得 pH 变化如图 1 所示,则该同学是将
A
(填字母序号)。A. 氢氧化钾溶液滴入稀硫酸中
B. 稀硫酸滴入氢氧化钾溶液中

(2) 测混合过程中的温度变化
乙同学在实验过程中测得反应混合溶液的温度变化如图 2 所示,说明稀硫酸与氢氧化钾溶液发生的反应是
放热
(填“放热”或“吸热”)反应。图中 B 点表示的含义是KOH和H₂SO₄恰好完全反应
。(3) 借助酸碱指示剂
丙同学通过图 3 所示实验,他观察到
溶液由红色变为无色
现象,也证明氢氧化钾溶液与稀硫酸发生了化学反应,反应的化学方程式为$2KOH + H_2SO_4 \longrightarrow K_2SO_4 + 2H_2O$
。【提出问题】针对反应后溶液中溶质的成分,大家纷纷提出了猜想。
【猜想与假设】
猜想一:只有 K₂SO₄;猜想二:有 K₂SO₄ 和 H₂SO₄;猜想三:有
K₂SO₄和KOH
。【进行实验】为了验证猜想,学习小组选用 Fe₂O₃ 粉末、BaCl₂ 溶液,进行如下探究:

【实验结论】通过探究,同学们一致确定猜想二是正确的。
【评价与反思】
(4) 丁同学针对上述方案提出疑问,认为方案二是不合理的,理由是
K₂SO₄也能与BaCl₂反应,产生白色沉淀,无法证明是否含有H₂SO₄
。(5) 同学们经过反思与讨论,最后认为方案一中的 Fe₂O₃ 粉末可以用下列的某些物质代替,也能得到同样的实验结论,请你选出可用试剂的字母序号
ABD
。A. Mg
B. CuO
C. KCl
D. Na₂CO₃
实验二:从溶液电导率变化探究中和反应
小组同学根据图 4 进行相关实验,利用电导率传感器分别测试 A、B 试管反应过程中溶液的电导率变化。(已知电导率越大,溶液中自由移动的离子浓度越大)

(7) 图 5 中表示 B 试管电导率变化的是
甲
(填“甲”或“乙”),C 点表示的溶液中溶质为硫酸钠、硫酸
。
答案:
14.
(1)A
(2)放热KOH和H₂SO₄恰好完全反应
(3)溶液由红色变为无色$2KOH + H_2SO_4 \longrightarrow K_2SO_4 + 2H_2O$K₂SO₄和KOHFe₂O₃粉末逐渐溶解,溶液由无色变黄色
(4)K₂SO₄也能与BaCl₂反应,产生白色沉淀,无法证明是否含有H₂SO₄
(5)ABD
(6)甲硫酸钠、硫酸
(1)A
(2)放热KOH和H₂SO₄恰好完全反应
(3)溶液由红色变为无色$2KOH + H_2SO_4 \longrightarrow K_2SO_4 + 2H_2O$K₂SO₄和KOHFe₂O₃粉末逐渐溶解,溶液由无色变黄色
(4)K₂SO₄也能与BaCl₂反应,产生白色沉淀,无法证明是否含有H₂SO₄
(5)ABD
(6)甲硫酸钠、硫酸
查看更多完整答案,请扫码查看


