第70页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
11. (11 分)实验是学习化学的重要途径。
Ⅰ. 实验室制取气体的一般思路和方法
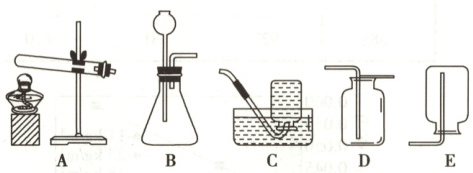
(1)确定反应原理:实验室制取 $O_{2}$ 所需的试剂是
(2)设计实验装置:根据你确定的试剂,选择的发生装置为
(3)验证制得气体:检验收集的气体是 $O_{2}$ 的方法是
Ⅱ. 配制 50 g 质量分数为 10%的氯化钠溶液
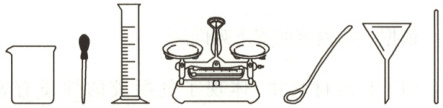
(4)计算需要氯化钠的质量为
(5)称量氯化钠时,发现天平的指针偏左,接下来的操作是
(6)配制过程中,上图中仪器不会用到的是
(7)将配制好的氯化钠溶液装入试剂瓶时有少量溶液洒出,该操作对所配制氯化钠溶液质量分数的影响是
Ⅰ. 实验室制取气体的一般思路和方法

(1)确定反应原理:实验室制取 $O_{2}$ 所需的试剂是
高锰酸钾
,其对应反应的化学方程式为$2KMnO_4 \stackrel{\triangle}{=\!=\!=} K_2MnO_4 + MnO_2 + O_2 \uparrow$
。(2)设计实验装置:根据你确定的试剂,选择的发生装置为
A
(填字母序号),选择该装置的依据是反应物是固体、反应条件加热
。若收集一瓶较纯净的 $O_{2}$ 气体,所选收集装置为C
(填字母序号)。(3)验证制得气体:检验收集的气体是 $O_{2}$ 的方法是
将带有火星的木条伸入集气瓶,木条复燃证明是氧气
。Ⅱ. 配制 50 g 质量分数为 10%的氯化钠溶液

(4)计算需要氯化钠的质量为
5
g,在量取蒸馏水时应选择量程为50
(填“10”“20”或“50”)mL 的量筒。(5)称量氯化钠时,发现天平的指针偏左,接下来的操作是
用药匙从左盘取下少量氯化钠至天平平衡
。(6)配制过程中,上图中仪器不会用到的是
漏斗
(填仪器名称)。(7)将配制好的氯化钠溶液装入试剂瓶时有少量溶液洒出,该操作对所配制氯化钠溶液质量分数的影响是
无影响
(填“偏大”“偏小”或“无影响”)。
答案:
11.Ⅰ.
(1)高锰酸钾$2KMnO_4 \stackrel{\triangle}{=\!=\!=} K_2MnO_4 + MnO_2 + O_2 \uparrow$
(或过氧化氢溶液和二氧化锰$2H_2O_2 \stackrel{MnO_2}{=\!=\!=} 2H_2O + O_2 \uparrow$)
(2)A 反应物是固体、反应条件加热(或:B 反应物是固体和液体,不需加热) C
(3)将带有火星的木条伸入集气瓶,木条复燃证明是氧气
Ⅱ.
(4)5 50
(5)用药匙从左盘取下少量氯化钠至天平平衡
(6)漏斗
(7)无影响
(1)高锰酸钾$2KMnO_4 \stackrel{\triangle}{=\!=\!=} K_2MnO_4 + MnO_2 + O_2 \uparrow$
(或过氧化氢溶液和二氧化锰$2H_2O_2 \stackrel{MnO_2}{=\!=\!=} 2H_2O + O_2 \uparrow$)
(2)A 反应物是固体、反应条件加热(或:B 反应物是固体和液体,不需加热) C
(3)将带有火星的木条伸入集气瓶,木条复燃证明是氧气
Ⅱ.
(4)5 50
(5)用药匙从左盘取下少量氯化钠至天平平衡
(6)漏斗
(7)无影响
12. (11 分)化学在生活、生产和社会发展中都发挥着重要作用。
Ⅰ. 化学与能源
新能源的开发和利用促进了能源结构向多元化、清洁和低碳转变。
(1)目前,人类利用的能量大多来自化石燃料,如石油、________和天然气。天然气的主要成分是甲烷($CH_{4}$),其完全燃烧的化学方程式为________。
(2)做饭时,天然气燃烧不充分,锅底易出现黑色物质。此时,可调
(3)氢气的发现、生产和应用极大地推动了人类社会的发展。科学家利用氨制氢的一种生产流程如下图所示。
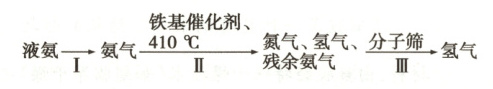
①步骤Ⅱ中发生反应的化学方程式为________。
②步骤Ⅲ中的分子筛只能让氢分子通过而阻止其他分子通过,该过程属于
③若用 50 kg 液氨制得了 6 kg 氢气,则该流程中氨气的转化率为
Ⅱ. 化学与化工
硫酸亚铁广泛用于医学、农业等领域,可利用菱铁矿进行制备。菱铁矿的主要成分是碳酸亚铁($FeCO_{3}$),还含有少量的二氧化硅($SiO_{2}$)和氧化铁($Fe_{2}O_{3}$)。以菱铁矿为原料制备硫酸亚铁的工艺流程如下图所示。
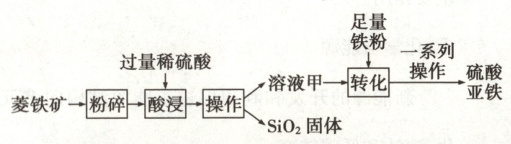
(4)硫酸亚铁可为人体补充铁元素,医学上可用于治疗
A. 贫血
B. 甲状腺疾病
C. 骨质疏松
D. 发育迟缓
(5)将菱铁矿粉碎的目的是
(6)$SiO_{2}$ 中硅元素的化合价是
(7)$Fe_{2}O_{3}$ 中铁元素和氧元素的质量比为
(8)溶液甲中一定含有的溶质是
Ⅰ. 化学与能源
新能源的开发和利用促进了能源结构向多元化、清洁和低碳转变。
(1)目前,人类利用的能量大多来自化石燃料,如石油、________和天然气。天然气的主要成分是甲烷($CH_{4}$),其完全燃烧的化学方程式为________。
(2)做饭时,天然气燃烧不充分,锅底易出现黑色物质。此时,可调
大
(填“大”或“小”)燃气灶的进风口,使燃料充分燃烧、节约能源。(3)氢气的发现、生产和应用极大地推动了人类社会的发展。科学家利用氨制氢的一种生产流程如下图所示。

①步骤Ⅱ中发生反应的化学方程式为________。
②步骤Ⅲ中的分子筛只能让氢分子通过而阻止其他分子通过,该过程属于
物理
(填“物理”或“化学”)变化。③若用 50 kg 液氨制得了 6 kg 氢气,则该流程中氨气的转化率为
68%
。(转化率 = $\frac{已反应的原料量}{原始原料量}×100\%$)Ⅱ. 化学与化工
硫酸亚铁广泛用于医学、农业等领域,可利用菱铁矿进行制备。菱铁矿的主要成分是碳酸亚铁($FeCO_{3}$),还含有少量的二氧化硅($SiO_{2}$)和氧化铁($Fe_{2}O_{3}$)。以菱铁矿为原料制备硫酸亚铁的工艺流程如下图所示。

(4)硫酸亚铁可为人体补充铁元素,医学上可用于治疗
A
(填选项字母)。A. 贫血
B. 甲状腺疾病
C. 骨质疏松
D. 发育迟缓
(5)将菱铁矿粉碎的目的是
增大接触面积,使反应更充分
。(6)$SiO_{2}$ 中硅元素的化合价是
+ 4
。(7)$Fe_{2}O_{3}$ 中铁元素和氧元素的质量比为
7:3
(填最简整数比)。(8)溶液甲中一定含有的溶质是
$FeSO_4$、$Fe_2(SO_4)_3$、$H_2SO_4$
(填化学式)。
答案:
12.Ⅰ.
(1)煤$CH_4 + 2O_2 \stackrel{点燃}{=\!=\!=} CO_2 + 2H_2O$
(2)大
(3)①$2NH_3 \stackrel{催化剂}{\underset{\triangle}{=\!=\!=}} N_2 + 3H_2$(或写铁基催化剂、$410°C$)
②物理 ③$68\%$
Ⅱ.
(4)A
(5)增大接触面积,使反应更充分(使反应更快)
(6) + 4
(7)$7:3$
(8)$FeSO_4$、$Fe_2(SO_4)_3$、$H_2SO_4$
(1)煤$CH_4 + 2O_2 \stackrel{点燃}{=\!=\!=} CO_2 + 2H_2O$
(2)大
(3)①$2NH_3 \stackrel{催化剂}{\underset{\triangle}{=\!=\!=}} N_2 + 3H_2$(或写铁基催化剂、$410°C$)
②物理 ③$68\%$
Ⅱ.
(4)A
(5)增大接触面积,使反应更充分(使反应更快)
(6) + 4
(7)$7:3$
(8)$FeSO_4$、$Fe_2(SO_4)_3$、$H_2SO_4$
查看更多完整答案,请扫码查看


