2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. 一定压强下,向$10 L$密闭容器中充入$1 mol S_{2}Cl_{2}$和$1 mol Cl_{2}$,发生反应$S_{2}Cl_{2}(g) + Cl_{2}(g)\rightleftharpoons 2SCl_{2}(g)$。$Cl_{2}$与$SCl_{2}$的消耗速率$(v)$与温度$(T)$的关系如图,下列说法错误的是(

A.$A$、$B$、$C$、$D$四点对应状态下达到平衡状态的为$A$点
B.正反应的活化能大于逆反应的活化能
C.一定温度下,在密闭容器中达到平衡后缩小容器容积,重新达到平衡后,$S_{2}Cl_{2}$的平衡转化率不变
D.若$Cl_{2}$的消耗速率$v(Cl_{2}) = k_{正}· c(S_{2}Cl_{2})· c(Cl_{2})$,$SCl_{2}$的消耗速率$v(SCl_{2}) = k_{逆}· c^{2}(SCl_{2})$,则该反应的平衡常数$K = \frac{2k_{正}}{k_{逆}}$
AB
)。
A.$A$、$B$、$C$、$D$四点对应状态下达到平衡状态的为$A$点
B.正反应的活化能大于逆反应的活化能
C.一定温度下,在密闭容器中达到平衡后缩小容器容积,重新达到平衡后,$S_{2}Cl_{2}$的平衡转化率不变
D.若$Cl_{2}$的消耗速率$v(Cl_{2}) = k_{正}· c(S_{2}Cl_{2})· c(Cl_{2})$,$SCl_{2}$的消耗速率$v(SCl_{2}) = k_{逆}· c^{2}(SCl_{2})$,则该反应的平衡常数$K = \frac{2k_{正}}{k_{逆}}$
答案:
15. AB 解析 反应达到平衡状态时,正、逆反应速率之比等于化学计量数之比,Cl₂ 与 SCl₂ 的消耗速率之比等于1:2时反应达到平衡状态,所以 A、B、C、D 四点对应状态下,达到平衡状态的为 B、D 点,A项错误;根据图示,升高温度,逆反应速率变化大于正反应速率变化,平衡逆向移动,正反应为放热反应,所以正反应的活化能小于逆反应的活化能,B项错误;该反应为反应前后气体分子数不变的反应,一定温度下,在恒容密闭容器中,达到平衡后缩小容器容积,增大压强,平衡不移动,S₂Cl₂ 的平衡转化率不变,C项正确;若 Cl₂ 的消耗速率 v(Cl₂)=kₐ·c(S₂Cl₂)·c(Cl₂),SCl₂ 的消耗速率 v(SCl₂)=kₑ·c²(SCl₂),达到平衡时 SCl₂ 的消耗速率 v(SCl₂)是 Cl₂ 的消耗速率 v(Cl₂) 的2倍,可得 kₑ·c²(SCl₂)=2kₐ·c(S₂Cl₂)·c(Cl₂),则该反应的平衡常数 K=c(N₂)·c²(CO₂)/c²(NO)·c²(CO)=2kₐ/kₑ,D项正确。
16. (10 分)汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为$2NO(g) + 2CO(g)\rightleftharpoons 2CO_{2}(g) + N_{2}(g)$。在密闭容器中发生该反应时,$c(CO_{2})$随温度$(T)$、催化剂的表面积$(S)$和时间$(t)$的变化曲线如图所示。
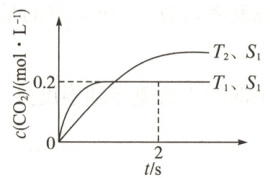
①该反应的$\Delta H$
②在$T_{1}$温度下,$0\sim 2 s$内的平均反应速率$v(N_{2}) =$
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则$CO$的平衡转化率
(2)工业上可采用$CH_{3}OH\rightleftharpoons CO + 2H_{2}$的方法来制取高纯度的$CO$和$H_{2}$。我国研究人员采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢气的反应历程,其中吸附在钯基催化剂表面上的物种用$*$标注。下图为计算机模拟的各步反应的能量变化示意图。

该历程中最大活化能$E_{正} =$
(1)汽车尾气净化的主要原理为$2NO(g) + 2CO(g)\rightleftharpoons 2CO_{2}(g) + N_{2}(g)$。在密闭容器中发生该反应时,$c(CO_{2})$随温度$(T)$、催化剂的表面积$(S)$和时间$(t)$的变化曲线如图所示。

①该反应的$\Delta H$
<
(填“$>$”或“$<$”,下同)$0$,$\Delta S$<
$0$。②在$T_{1}$温度下,$0\sim 2 s$内的平均反应速率$v(N_{2}) =$
0.05 mol·L⁻¹·s⁻¹
。③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则$CO$的平衡转化率
不变
(填“增大”“减少”或“不变”)。(2)工业上可采用$CH_{3}OH\rightleftharpoons CO + 2H_{2}$的方法来制取高纯度的$CO$和$H_{2}$。我国研究人员采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢气的反应历程,其中吸附在钯基催化剂表面上的物种用$*$标注。下图为计算机模拟的各步反应的能量变化示意图。

该历程中最大活化能$E_{正} =$
179.6
$kJ· mol^{-1}$;该历程中,放热最多的步骤的化学方程式为CHO⁺+3H⁺=CO⁺+4H⁺(或CHO⁺=CO⁺+H⁺)
。
答案:
16.答案
(1)①<
②0.05 mol·L⁻¹·s⁻¹
③不变
(2)179.6 CHO⁺+3H⁺=CO⁺+4H⁺(或CHO⁺=CO⁺+H⁺)
解析
(1)①T₁ 温度下反应先达到平衡状态,可知 T₁>T₂,温度越高 c(CO₂)越小,平衡向逆反应方向移动,则正反应为放热反应,即该反应的 ΔH<0;该反应是气体体积减小的反应,ΔS<0。
②在 T₁ 温度下,0~2 s 内的平均反应速率 v(N₂)=1/2v(CO₂)=1/2×0.2 mol·L⁻¹/2 s=0.05 mol·L⁻¹·s⁻¹。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率,但不能使平衡发生移动,若增大催化剂的表面积,则 CO 的平衡转化率不变。
(2)从图像中可以看出,CO⁺+4H⁺=CO⁺+2H₂(g)的过程中,活化能最大,数值等于113.9 kJ·mol⁻¹−(−65.7 kJ·mol⁻¹)=179.6 kJ·mol⁻¹,该历程中最大能垒(活化能)Eₑ=179.6 kJ·mol⁻¹;该历程中,放热最多的步骤的化学方程式为 CHO⁺+3H⁺=CO⁺+4H⁺(或 CHO⁺=CO⁺+H⁺)。
(1)①<
②0.05 mol·L⁻¹·s⁻¹
③不变
(2)179.6 CHO⁺+3H⁺=CO⁺+4H⁺(或CHO⁺=CO⁺+H⁺)
解析
(1)①T₁ 温度下反应先达到平衡状态,可知 T₁>T₂,温度越高 c(CO₂)越小,平衡向逆反应方向移动,则正反应为放热反应,即该反应的 ΔH<0;该反应是气体体积减小的反应,ΔS<0。
②在 T₁ 温度下,0~2 s 内的平均反应速率 v(N₂)=1/2v(CO₂)=1/2×0.2 mol·L⁻¹/2 s=0.05 mol·L⁻¹·s⁻¹。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率,但不能使平衡发生移动,若增大催化剂的表面积,则 CO 的平衡转化率不变。
(2)从图像中可以看出,CO⁺+4H⁺=CO⁺+2H₂(g)的过程中,活化能最大,数值等于113.9 kJ·mol⁻¹−(−65.7 kJ·mol⁻¹)=179.6 kJ·mol⁻¹,该历程中最大能垒(活化能)Eₑ=179.6 kJ·mol⁻¹;该历程中,放热最多的步骤的化学方程式为 CHO⁺+3H⁺=CO⁺+4H⁺(或 CHO⁺=CO⁺+H⁺)。
查看更多完整答案,请扫码查看


