2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
16. (14 分)原电池是化学对人类的一项重大贡献。
(1)依据反应${2Ag^{+}(aq) + Cu(s) = Cu^{2+}(aq) + 2Ag(s)}$设计的原电池如图所示。请回答下列问题。

①电极${X}$的材料是
②银电极为电池的正极,发生的电极反应为
③导线上转移${0.2 mol}$电子时,${Cu}$片质量减轻
(2)铅酸蓄电池在放电时发生的电池反应为${Pb + PbO_{2} + 2H_{2}SO_{4} = 2PbSO_{4} + 2H_{2}O}$,负极的电极反应式为
(3)${Li - SOCl_{2}}$电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是${LiAlCl_{4}}$、${SOCl_{2}}$溶液。电池的总反应可表示为${4Li + 2SOCl_{2} = 4LiCl + S + SO_{2}↑}$。则该电池正极的电极反应式为________。
(1)依据反应${2Ag^{+}(aq) + Cu(s) = Cu^{2+}(aq) + 2Ag(s)}$设计的原电池如图所示。请回答下列问题。

①电极${X}$的材料是
Cu
(填化学式);电解质溶液${Y}$是AgNO₃
溶液。②银电极为电池的正极,发生的电极反应为
Ag⁺ + e⁻ = Ag
。③导线上转移${0.2 mol}$电子时,${Cu}$片质量减轻
6.4
${g}$。(2)铅酸蓄电池在放电时发生的电池反应为${Pb + PbO_{2} + 2H_{2}SO_{4} = 2PbSO_{4} + 2H_{2}O}$,负极的电极反应式为
Pb + SO₄²⁻ - 2e⁻ = PbSO₄
。(3)${Li - SOCl_{2}}$电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是${LiAlCl_{4}}$、${SOCl_{2}}$溶液。电池的总反应可表示为${4Li + 2SOCl_{2} = 4LiCl + S + SO_{2}↑}$。则该电池正极的电极反应式为________。
答案:
16.答案
(1)①Cu AgNO₃ ②Ag⁺ + e⁻ = Ag ③6.4
(2)Pb + SO₄²⁻ - 2e⁻ = PbSO₄
(3)2SOCl₂ + 4e⁻ = 4Cl⁻ + S + SO₂↑
(1)①Cu AgNO₃ ②Ag⁺ + e⁻ = Ag ③6.4
(2)Pb + SO₄²⁻ - 2e⁻ = PbSO₄
(3)2SOCl₂ + 4e⁻ = 4Cl⁻ + S + SO₂↑
17. (14 分)钢铁工业是国家工业的基础之一。请回答下列有关钢铁腐蚀、防护过程中的问题。
(1)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是
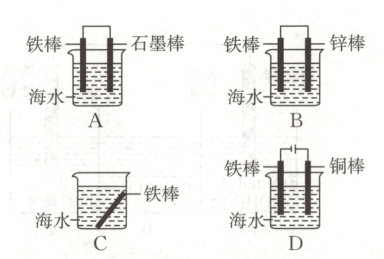
(2)下列装置可防止铁棒被腐蚀的是
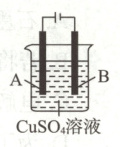
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀,装置如图所示。
①${A}$电极对应的金属是
②若电镀前铁、铜两电极质量相同,电镀完成后将它们取出洗净、烘干、称量,两者质量差为${5.12 g}$,则电镀时电路中通过的电子的物质的量为
③镀层破损后,镀铜铁比镀锌铁更易被腐蚀,简要说明原因:________。
(1)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是
2FeCl₃ + Fe = 3FeCl₂
。(2)下列装置可防止铁棒被腐蚀的是
BD
(填字母)。(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀,装置如图所示。
①${A}$电极对应的金属是
铜
(填元素名称),${B}$电极上发生的电极反应是Cu²⁺ + 2e⁻ = Cu
。②若电镀前铁、铜两电极质量相同,电镀完成后将它们取出洗净、烘干、称量,两者质量差为${5.12 g}$,则电镀时电路中通过的电子的物质的量为
0.08
${mol}$。③镀层破损后,镀铜铁比镀锌铁更易被腐蚀,简要说明原因:________。


答案:
17.答案
(1)2FeCl₃ + Fe = 3FeCl₂
(2)BD
(3)①铜 Cu²⁺ + 2e⁻ = Cu ②0.08 ③铁比铜活泼,铜镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速了铁的腐蚀。而锌比铁活泼,锌镀层破坏后,在潮湿环境中形成原电池,铁为正极,减慢了铁的腐蚀(其他合理答案也可)
解析
(1)铁锈的主要成分是氧化铁,氧化铁与盐酸反应生成FeCl₃,FeCl₃与Fe反应生成FeCl₂,该反应属于化合反应。
(2)铁被保护的装置,在原电池中,铁作正极;在电解池中,铁作阴极。
(3)①电镀池中,镀层铜作阳极。②根据阳极电极反应Cu - 2e⁻ = Cu²⁺,阴极电极反应Cu²⁺ + 2e⁻ = Cu,可知两极相差5.12 g时,阳极被氧化的铜和阴极析出的铜质量相等,即2.56 g,转移电子的物质的量为2.56 g/64 g·mol⁻¹ × 2 = 0.08 mol。③金属活动性Zn>Fe>Cu,当Fe作负极时易被腐蚀。
(1)2FeCl₃ + Fe = 3FeCl₂
(2)BD
(3)①铜 Cu²⁺ + 2e⁻ = Cu ②0.08 ③铁比铜活泼,铜镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速了铁的腐蚀。而锌比铁活泼,锌镀层破坏后,在潮湿环境中形成原电池,铁为正极,减慢了铁的腐蚀(其他合理答案也可)
解析
(1)铁锈的主要成分是氧化铁,氧化铁与盐酸反应生成FeCl₃,FeCl₃与Fe反应生成FeCl₂,该反应属于化合反应。
(2)铁被保护的装置,在原电池中,铁作正极;在电解池中,铁作阴极。
(3)①电镀池中,镀层铜作阳极。②根据阳极电极反应Cu - 2e⁻ = Cu²⁺,阴极电极反应Cu²⁺ + 2e⁻ = Cu,可知两极相差5.12 g时,阳极被氧化的铜和阴极析出的铜质量相等,即2.56 g,转移电子的物质的量为2.56 g/64 g·mol⁻¹ × 2 = 0.08 mol。③金属活动性Zn>Fe>Cu,当Fe作负极时易被腐蚀。
查看更多完整答案,请扫码查看


